Namenda: Alzheimer-Medikament
Namenda ist ein Medikament zur Behandlung der Alzheimer-Krankheit. Detaillierte Informationen zu Anwendung, Dosierung und Nebenwirkungen von Namenda.
Markenname: Namenda
Generischer Name: Memantinhydrochlorid
Namenda (Memantinhydrochlorid) ist ein Medikament zur Behandlung der Alzheimer-Krankheit. Detaillierte Informationen zu Anwendungen, Dosierung und Nebenwirkungen von Namenda finden Sie weiter unten.
Inhalt:
Beschreibung
Pharmakologie
Indikationen und Verwendung
Kontraindikationen
Vorsichtsmaßnahmen
Wechselwirkungen mit anderen Medikamenten
Nebenwirkungen
Überdosis
Dosierung
Geliefert
Anweisungen für den Patienten
Namenda Patienteninformation (in Klartext)
Beschreibung
Namenda® (Memantinhydrochlorid) ist ein oral wirksamer NMDA-Rezeptorantagonist. Die chemische Bezeichnung für Memantinhydrochlorid lautet 1-Amino-3,5-dimethyladamantanhydrochlorid mit der folgenden Strukturformel:
Quelle: Forest Laboratories, US-Distributor oder Namenda.
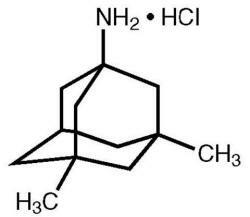
Die Molekularformel lautet C 12 H 21 N · HCl und das Molekulargewicht beträgt 215,76.
Memantin HCl liegt als feines weißes bis cremefarbenes Pulver vor und ist wasserlöslich. Namenda ist als Tabletten oder als Lösung zum Einnehmen erhältlich. Namenda ist zur oralen Verabreichung als kapselförmige Filmtabletten mit 5 mg und 10 mg Memantinhydrochlorid erhältlich. Die Tabletten enthalten auch die folgenden inaktiven Bestandteile: mikrokristalline Cellulose, Lactosemonohydrat, kolloidales Siliciumdioxid, Talk und Magnesiumstearat. Zusätzlich sind folgende inaktive Inhaltsstoffe als Bestandteile des Filmüberzugs enthalten: Hypromellose, Triacetin, Titandioxid, FD & C Gelb Nr. 6 und FD & C Blau Nr. 2 (5 mg Tabletten), Eisenoxidschwarz (10 mg Tabletten). Namenda Lösung zum Einnehmen enthält Memantinhydrochlorid in einer Stärke, die 2 mg Memantinhydrochlorid pro ml entspricht. Die Lösung zum Einnehmen enthält außerdem die folgenden inaktiven Bestandteile: Sorbitollösung (70%), Methylparaben, Propylparaben, Propylenglykol, Glycerin, natürliches Pfefferminzaroma Nr. 104, Zitronensäure, Natriumcitrat und gereinigt Wasser.
Klinische Pharmakologie
Wirkmechanismus und Pharmakodynamik
Anhaltende Aktivierung der N-Methyl-D-Aspartat (NMDA) -Rezeptoren des Zentralnervensystems durch die Es wurde die Hypothese aufgestellt, dass die exzitatorische Aminosäure Glutamat zur Symptomatologie von Glutamat beiträgt Alzheimer-Erkrankung. Es wird postuliert, dass Memantin seine therapeutische Wirkung durch seine Wirkung als geringe bis mäßige Affinität ausübt nichtkompetitiver (offener Kanal) NMDA-Rezeptor-Antagonist, der bevorzugt an den mit NMDA-Rezeptor betriebenen bindet Kationskanäle. Es gibt keine Hinweise darauf, dass Memantin die Neurodegeneration bei Patienten mit Alzheimer-Krankheit verhindert oder verlangsamt.
Memantin zeigte eine geringe bis vernachlässigbare Affinität für GABA-, Benzodiazepin-, Dopamin-, adrenerge, Histamin- und Glycinrezeptoren sowie für spannungsabhängige Ca 2+ -, Na + - oder K + -Kanäle. Memantin zeigte auch antagonistische Wirkungen am 5HT 3 -Rezeptor mit einer ähnlichen Wirksamkeit wie für der NMDA-Rezeptor blockiert und nikotinische Acetylcholin-Rezeptoren mit einem Sechstel bis einem Zehntel des Potenz.
In-vitro-Studien haben gezeigt, dass Memantin die reversible Hemmung der Acetylcholinesterase durch Donepezil, Galantamin oder Tacrin nicht beeinflusst.
Pharmakokinetik
Memantin wird nach oraler Verabreichung gut resorbiert und weist über den therapeutischen Dosisbereich eine lineare Pharmakokinetik auf. Es wird unverändert überwiegend im Urin ausgeschieden und hat eine terminale Eliminationshalbwertszeit von ca. 60-80 Stunden.
Absorption und Verteilung
Nach oraler Verabreichung wird Memantin stark resorbiert, wobei Spitzenkonzentrationen nach etwa 3 bis 7 Stunden erreicht werden. Nahrung hat keinen Einfluss auf die Aufnahme von Memantin. Das mittlere Verteilungsvolumen von Memantin beträgt 9-11 l / kg und die Plasmaproteinbindung ist gering (45%).
Stoffwechsel und Ausscheidung
Memantin unterliegt einem partiellen Leberstoffwechsel. Etwa 48% des verabreichten Arzneimittels werden unverändert im Urin ausgeschieden. der Rest wird hauptsächlich in drei polare Metaboliten umgewandelt, die einen minimalen NMDA-Rezeptor besitzen antagonistische Aktivität: das N-Glucuronid-Konjugat, 6-Hydroxy-Memantin und 1-Nitroso-desaminiert memantine. Insgesamt 74% der verabreichten Dosis werden als Summe des Ausgangsarzneimittels und des N-Glucuronid-Konjugats ausgeschieden. Das hepatische mikrosomale CYP450-Enzymsystem spielt keine signifikante Rolle im Metabolismus von Memantin. Memantin hat eine terminale Eliminationshalbwertszeit von etwa 60-80 Stunden. Die renale Clearance beinhaltet eine aktive tubuläre Sekretion, die durch pH-abhängige tubuläre Reabsorption moderiert wird.
Besondere Bevölkerungsgruppen
Nierenfunktionsstörung: Die Pharmakokinetik von Memantin wurde nach einmaliger oraler Gabe von 20 mg Memantin HCl bei 8 Probanden mit leichter Nierenfunktionsstörung untersucht (Kreatinin-Clearance, CLcr,> 50 - 80 ml / min), 8 Patienten mit mäßiger Nierenfunktionsstörung (CLcr 30 - 49 ml / min), 7 Patienten mit schwerer Nierenfunktionsstörung (CLcr 5 - 29 ml / min) und 8 gesunde Probanden (CLcr> 80 ml / min) stimmten nach Alter, Gewicht und Geschlecht so gut wie möglich mit den Probanden mit Niereninsuffizienz überein Beeinträchtigung. Die mittlere AUC 0- (unendlich) stieg bei Probanden mit leichter, mittelschwerer und schwerer Nierenfunktionsstörung im Vergleich zu gesunden Probanden um 4%, 60% und 115%. Die terminale Eliminationshalbwertszeit stieg bei Probanden mit leichter, mittlerer und schwerer Nierenfunktionsstörung im Vergleich zu gesunden Probanden um 18%, 41% und 95%.
Bei Patienten mit leichter und mäßiger Nierenfunktionsstörung wird keine Dosisanpassung empfohlen. Bei Patienten mit schwerer Nierenfunktionsstörung sollte die Dosierung reduziert werden (siehe DOSIERUNG UND ANWENDUNG).
Alten: Die Pharmakokinetik von Namenda bei jungen und älteren Probanden ist ähnlich.
Geschlecht: Nach mehrfacher Verabreichung von Namenda 20 mg b.i.
Arzneimittel-Wechselwirkungen
Substrate mikrosomaler Enzyme: In-vitro-Studien zeigten, dass Memantin bei Konzentrationen, die über die mit der Wirksamkeit verbundenen Konzentrationen hinausgehen, die Cytochrom-P450-Isozyme CYP1A2, CYP2C9, CYP2E1 und CYP3A4 / 5 nicht induziert. In-vitro-Studien haben außerdem gezeigt, dass Memantin die CYP450-Enzyme CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 und CYP3A4 nur minimal hemmt. Diese Daten deuten darauf hin, dass keine pharmakokinetischen Wechselwirkungen mit Arzneimitteln zu erwarten sind, die durch diese Enzyme metabolisiert werden.
Inhibitoren mikrosomaler Enzyme: Da Memantin nur einen minimalen Metabolismus aufweist und der größte Teil der Dosis unverändert im Urin ausgeschieden wird, ist eine Wechselwirkung zwischen Memantin und Arzneimitteln, die CYP450-Enzyme hemmen, unwahrscheinlich. Die gleichzeitige Anwendung von Namenda mit dem AChE-Hemmer Donepezil HCl beeinflusst die Pharmakokinetik beider Verbindungen nicht.
Über Nierenmechanismen ausgeschiedene Medikamente: Memantin wird teilweise durch tubuläre Sekretion eliminiert. In-vivo-Studien haben gezeigt, dass Mehrfachdosen des Diuretikums Hydrochlorothiazid / Triamteren (HCTZ / TA) die AUC von Memantin im Steady State nicht beeinflussten. Memantin hatte keinen Einfluss auf die Bioverfügbarkeit von TA und verringerte die AUC und Cmax von HCTZ um etwa 20%. Die gleichzeitige Anwendung von Memantin mit dem antihyperglykämischen Arzneimittel Glucovance® (Glyburid und Metformin HCl) hatte keinen Einfluss auf die Pharmakokinetik von Memantin, Metformin und Glyburid. Memantin veränderte die die Serumglukose senkende Wirkung von Glucovance® nicht, was auf das Fehlen einer pharmakodynamischen Wechselwirkung hinweist.
Drogen, die den Urin alkalisch machen: Die Clearance von Memantin wurde unter alkalischen Urinbedingungen bei pH 8 um etwa 80% verringert. Änderungen des Urin-pH-Werts in Richtung des alkalischen Zustands können daher zu einer Akkumulation des Arzneimittels mit einer möglichen Zunahme der Nebenwirkungen führen. Medikamente, die den Urin alkalisieren (z. B. Carboanhydrase-Hemmer, Natriumbicarbonat), dürften die renale Elimination von Memantin verringern.
Medikamente, die stark an Plasmaproteine gebunden sind: Da die Plasmaproteinbindung von Memantin gering ist (45%), ist eine Wechselwirkung mit Arzneimitteln, die stark an Plasmaproteine gebunden sind, wie Warfarin und Digoxin, unwahrscheinlich.
KLINISCHE VERSUCHE
Die Wirksamkeit von Namenda (Memantinhydrochlorid) zur Behandlung von Patienten mit mittelschwerer bis schwerer Alzheimer-Krankheit wurde in 2 randomisierten Studien gezeigt. In den USA durchgeführte doppelblinde, placebokontrollierte klinische Studien (Studien 1 und 2), in denen sowohl die kognitive Funktion als auch die Alltagsfunktion untersucht wurden. Das Durchschnittsalter der Patienten, die an diesen beiden Studien teilnahmen, betrug 76 Jahre und lag zwischen 50 und 93 Jahren. Ungefähr 66% der Patienten waren weiblich und 91% der Patienten waren kaukasisch.
In einer dritten in Lettland durchgeführten Studie (Studie 3) wurden Patienten mit schwerer Demenz eingeschlossen, die kognitive Funktion wurde jedoch nicht als geplanter Endpunkt bewertet.
Ergebnisse der Studie: In jeder US-Studie wurde die Wirksamkeit von Namenda mit beiden Instrumenten bestimmt Entwickelt, um die Gesamtfunktion durch eine Beurteilung der Bezugsperson zu bewerten, und ein Instrument, das misst Erkenntnis. Beide Studien zeigten, dass bei Namenda-Patienten eine signifikante Verbesserung beider Maßnahmen im Vergleich zu Placebo zu verzeichnen war.
Die Alltagsfunktion wurde in beiden Studien unter Verwendung der modifizierten Alzheimer-Genossenschaftsstudie - Aktivitäten des täglichen Lebens (ADCS-ADL) bewertet. Das ADCS-ADL besteht aus einer umfassenden Sammlung von ADL-Fragen, mit denen die Funktionsfähigkeit von Patienten gemessen wird. Jedes ADL-Element wird von der höchsten Stufe der unabhängigen Leistung bis zum vollständigen Verlust bewertet. Der Prüfer führt die Bestandsaufnahme durch, indem er eine Pflegekraft befragt, die mit dem Verhalten des Patienten vertraut ist. Eine Teilmenge von 19 Artikeln, einschließlich Bewertungen der Fähigkeit des Patienten zu essen, sich anzuziehen, zu baden, zu telefonieren, zu reisen, einzukaufen, und andere Hausarbeiten durchführen wurde für die Beurteilung von Patienten mit mittelschweren bis schweren validiert Demenz. Dies ist die modifizierte ADCS-ADL, die einen Bewertungsbereich von 0 bis 54 aufweist, wobei die niedrigeren Bewertungen auf eine größere Funktionsbeeinträchtigung hinweisen.
Die Fähigkeit von Namenda zur Verbesserung der kognitiven Leistung wurde in beiden Studien mit der Severe Impairment Battery (SIB), a, untersucht Multi-Item-Instrument, das für die Bewertung der kognitiven Funktion bei Patienten mit mittelschweren bis schweren validiert wurde Demenz. Das SIB untersucht ausgewählte Aspekte der kognitiven Leistung, einschließlich der Elemente Aufmerksamkeit, Orientierung, Sprache, Gedächtnis, visuelle Fähigkeit, Konstruktion, Praxis und soziale Interaktion. Der SIB-Bewertungsbereich reicht von 0 bis 100, wobei niedrigere Bewertungen auf eine größere kognitive Beeinträchtigung hinweisen.
Studie 1 (Achtundzwanzigwöchige Studie)
In einer 28-wöchigen Studie wurden 252 Patienten mit mittelschwerer bis schwerer wahrscheinlicher Alzheimer-Krankheit (diagnostiziert durch DSM-IV und NINCDS-ADRDA) untersucht Kriterien, mit Mini-Mental State Examination Scores> / = 3 und! - = 14 und Global Deterioration Scale Stages 5-6) wurden nach Namenda oder randomisiert Placebo. Bei nach Namenda randomisierten Patienten wurde die Behandlung mit 5 mg einmal täglich begonnen und wöchentlich um 5 mg / Tag in aufgeteilten Dosen auf eine Dosis von 20 mg / Tag (10 mg zweimal täglich) erhöht.
Auswirkungen auf die ADCS-ADL:
Abbildung 1 zeigt den zeitlichen Verlauf der Änderung des ADCS-ADL-Scores gegenüber dem Ausgangswert für Patienten in den beiden Behandlungsgruppen, die die 28 Wochen der Studie abgeschlossen haben. Nach 28-wöchiger Behandlung betrug der mittlere Unterschied in den ADCS-ADL-Änderungswerten für die mit Namenda behandelten Patienten im Vergleich zu den mit Placebo behandelten Patienten 3,4 Einheiten. Unter Verwendung einer Analyse, die auf allen Patienten beruhte und deren letzte Studienbeobachtung weiterführte (LOCF-Analyse), war die Namenda-Behandlung dem Placebo statistisch signifikant überlegen.

Abbildung 1: Zeitlicher Verlauf der Änderung des ADCS-ADL-Scores gegenüber dem Ausgangswert bei Patienten, die die 28-wöchige Behandlung abgeschlossen haben.
2 zeigt die kumulativen Prozentsätze von Patienten aus jeder der Behandlungsgruppen, die mindestens die auf der X-Achse gezeigte Änderung der ADCS-ADL erreicht hatten.
Die Kurven zeigen, dass beide Patienten, die mit Namenda und Placebo behandelt wurden, unterschiedlich ansprechen und im Allgemeinen eine Verschlechterung aufweisen (a negative Änderung der ADCS-ADL im Vergleich zum Ausgangswert), die Namenda-Gruppe zeigt jedoch mit größerer Wahrscheinlichkeit einen geringeren Rückgang oder einen geringeren Rückgang Verbesserung. (In einer kumulativen Verteilungsanzeige würde eine Kurve für eine wirksame Behandlung nach links von der Kurve für verschoben Placebo, während eine unwirksame oder schädliche Behandlung überlagert oder nach rechts von der Kurve für verschoben würde Placebo.)
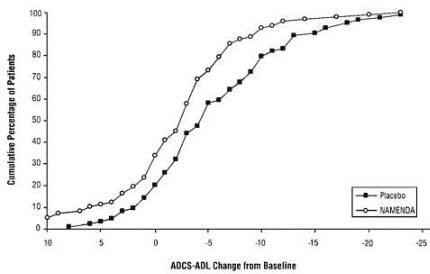
Abbildung 2: Kumulativer Prozentsatz der Patienten, die eine 28-wöchige doppelblinde Behandlung mit festgelegten Änderungen der ADCS-ADL-Scores gegenüber dem Ausgangswert abgeschlossen haben.
Auswirkungen auf das SIB: Abbildung 3 zeigt den zeitlichen Verlauf der Änderung des SIB-Scores gegenüber dem Ausgangswert für die beiden Behandlungsgruppen über die 28 Wochen der Studie. Nach 28-wöchiger Behandlung betrug der mittlere Unterschied in den SIB-Änderungswerten für die mit Namenda behandelten Patienten im Vergleich zu den mit Placebo behandelten Patienten 5,7 Einheiten. Unter Verwendung einer LOCF-Analyse war die Namenda-Behandlung dem Placebo statistisch signifikant überlegen.
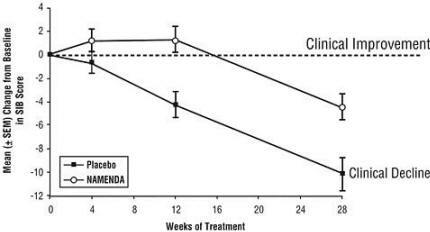
Abbildung 3: Zeitverlauf der Änderung des SIB-Scores gegenüber dem Ausgangswert für Patienten, die die 28-wöchige Behandlung abgeschlossen haben.
4 zeigt die kumulativen Prozentsätze von Patienten aus jeder Behandlungsgruppe, die mindestens das auf der X-Achse gezeigte Maß für die Änderung des SIB-Scores erreicht hatten.
Die Kurven zeigen, dass beide Patienten, die Namenda und Placebo zugeordnet wurden, ein breites Spektrum an Reaktionen aufweisen und zeigen im Allgemeinen eine Verschlechterung, aber dass die Namenda-Gruppe eher einen geringeren Rückgang oder eine geringere Verschlechterung zeigt Verbesserung.
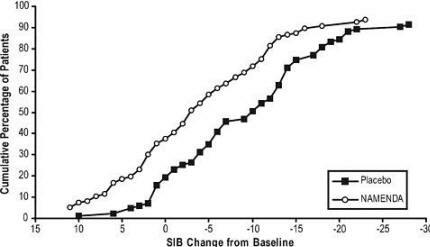
Abbildung 4: Kumulativer Prozentsatz der Patienten, die eine 28-wöchige doppelblinde Behandlung mit festgelegten Änderungen der SIB-Scores gegenüber dem Ausgangswert abgeschlossen haben.
Studie 2 (24-wöchige Studie) In einer 24-wöchigen Studie wurden 404 Patienten mit mittelschwerer bis schwerer Erkrankung untersucht wahrscheinliche Alzheimer-Krankheit (diagnostiziert nach NINCDS-ADRDA-Kriterien, mit Mini-Mental State Examination Partituren ≥ 5 und ≤ 14) die seit mindestens 6 Monaten mit Donepezil behandelt wurden und eine stabile Dosis von Donepezil für die letzten 3 Monate wurden zu Namenda oder Placebo randomisiert, während immer noch erhalten Donepezil. Bei nach Namenda randomisierten Patienten wurde die Behandlung mit 5 mg einmal täglich begonnen und wöchentlich um 5 mg / Tag in aufgeteilten Dosen auf eine Dosis von 20 mg / Tag (10 mg zweimal täglich) erhöht.
Auswirkungen auf die ADCS-ADL: Abbildung 5 zeigt den zeitlichen Verlauf der Änderung des ADCS-ADL-Scores gegenüber dem Ausgangswert für die beiden Behandlungsgruppen über die 24 Wochen der Studie. Nach 24-wöchiger Behandlung ändert sich der mittlere Unterschied in den ADCS-ADL-Werten für Namenda / Donepezil behandelten Patienten (Kombinationstherapie) im Vergleich zu den Patienten unter Placebo / Donepezil (Monotherapie) betrug 1,6 Einheiten. Unter Verwendung einer LOCF-Analyse war die Namenda / Donepezil-Behandlung Placebo / Donepezil statistisch signifikant überlegen.
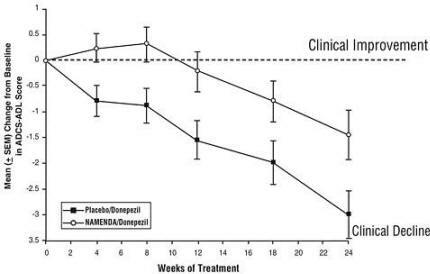
Abbildung 5: Zeitverlauf der Änderung des ADCS-ADL-Scores gegenüber dem Ausgangswert für Patienten, die die 24-wöchige Behandlung abgeschlossen haben.
6 zeigt die kumulativen Prozentsätze von Patienten aus jeder der Behandlungsgruppen, die mindestens das auf der X-Achse gezeigte Verbesserungsmaß für die ADCS-ADL erreicht hatten.
Die Kurven zeigen, dass beide Patienten, die mit Namenda / Donepezil und Placebo / Donepezil behandelt wurden, ein breites Spektrum an Reaktionen aufweisen und zeigen im Allgemeinen eine Verschlechterung, aber dass die Namenda / Donepezil-Gruppe eher einen geringeren Rückgang oder eine geringere Verschlechterung zeigt Verbesserung.
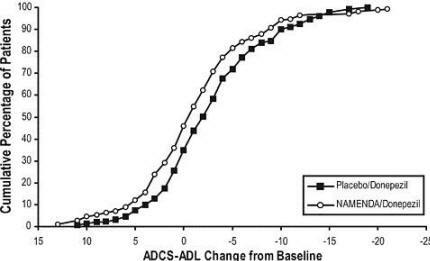
Abbildung 6: Kumulativer Prozentsatz der Patienten, die eine 24-wöchige doppelblinde Behandlung mit festgelegten Änderungen der ADCS-ADL-Scores gegenüber dem Ausgangswert abgeschlossen haben.
Auswirkungen auf das SIB: Abbildung 7 zeigt den zeitlichen Verlauf der Änderung des SIB-Scores gegenüber dem Ausgangswert für die beiden Behandlungsgruppen über die 24 Wochen der Studie. Nach 24-wöchiger Behandlung betrug der mittlere Unterschied in den SIB-Änderungswerten für die mit Namenda / Donepezil behandelten Patienten im Vergleich zu den mit Placebo / Donepezil behandelten Patienten 3,3 Einheiten. Unter Verwendung einer LOCF-Analyse war die Namenda / Donepezil-Behandlung Placebo / Donepezil statistisch signifikant überlegen.
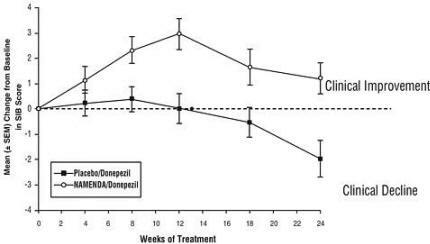
Abbildung 7: Zeitverlauf der Änderung des SIB-Scores gegenüber dem Ausgangswert für Patienten, die die 24-wöchige Behandlung abgeschlossen haben.
8 zeigt die kumulativen Prozentsätze von Patienten aus jeder Behandlungsgruppe, die mindestens das auf der X-Achse gezeigte Maß für die Verbesserung des SIB-Scores erreicht hatten.
Die Kurven zeigen, dass beide Patienten, denen Namenda / Donepezil und Placebo / Donepezil zugewiesen wurden, ein breites Spektrum aufweisen der Antworten, aber dass die Namenda / Donepezil-Gruppe eher eine Verbesserung oder eine kleinere zeigt Ablehnen.
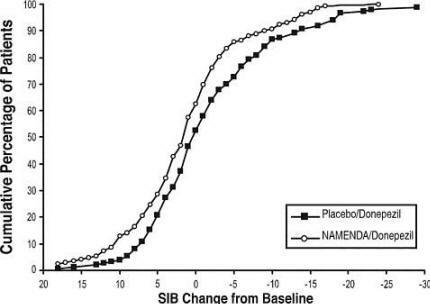
Abbildung 8: Kumulativer Prozentsatz der Patienten, die eine 24-wöchige doppelblinde Behandlung mit festgelegten Änderungen der SIB-Scores gegenüber dem Ausgangswert abgeschlossen haben.
Studie 3 (zwölfwöchige Studie) In einer zwölfwöchigen Doppelblindstudie, die in Pflegeheimen in Lettland durchgeführt wurde, wurden 166 Patienten mit Demenz untersucht DSM-III-R, eine Bewertung für die Prüfung des Mini-Geisteszustands von <10 und eine Einstufung der globalen Verschlechterungsskala von 5 bis 7 wurden entweder nach Namenda oder randomisiert Placebo. Bei Patienten, die nach dem Zufallsprinzip zu Namenda randomisiert wurden, wurde die Behandlung mit 5 mg einmal täglich begonnen und nach 1 Woche auf 10 mg einmal täglich erhöht. Die primären Wirksamkeitsmaße waren die Unterskala für die Pflegebedürftigkeit der Verhaltensbewertungsskala für geriatrische Patienten (BGP), ein Maß für die tägliche Funktion, und ein klinischer globaler Eindruck von Veränderung (CGI-C), ein Maß für die klinische Gesamtfunktion bewirken. In dieser Studie wurde kein gültiges Maß für die kognitive Funktion verwendet. Ein statistisch signifikanter Behandlungsunterschied nach 12 Wochen, der Namenda gegenüber Placebo bevorzugte, wurde bei beiden primären Wirksamkeitsmessungen beobachtet. Da es sich bei den eingegebenen Patienten um eine Mischung aus Alzheimer-Krankheit und vaskulärer Demenz handelte, wurde versucht, die beiden Gruppen und alle zu unterscheiden Patienten wurden später entweder als Patienten mit vaskulärer Demenz oder mit Alzheimer-Krankheit eingestuft, basierend auf ihren Punktzahlen auf der Hachinski-Ischämie-Skala bei der Studie Eintrag. Nur etwa 50% der Patienten hatten eine Computertomographie des Gehirns. Für die Untergruppe mit der Bezeichnung Alzheimer-Krankheit wurde sowohl bei BGP als auch bei CGI-C ein statistisch signifikanter Behandlungseffekt zugunsten von Namenda gegenüber Placebo nach 12 Wochen beobachtet.
Indikationen und Verwendung
Namenda (Memantinhydrochlorid) ist zur Behandlung von mittelschwerer bis schwerer Demenz vom Alzheimer-Typ indiziert.
Kontraindikationen
Namenda (Memantinhydrochlorid) ist bei Patienten mit bekannter Überempfindlichkeit gegen Memantinhydrochlorid oder einen der in der Formulierung verwendeten sonstigen Bestandteile kontraindiziert.
Vorsichtsmaßnahmen
Informationen für Patienten und Pflegepersonen: Das Pflegepersonal sollte in die empfohlene Verabreichung (zweimal täglich für Dosen über 5 mg) und Dosissteigerung (Mindestintervall von einer Woche zwischen Dosiserhöhungen) eingewiesen werden.
Neurologische Zustände Anfälle:
Namenda wurde bei Patienten mit Anfallsleiden nicht systematisch untersucht. In klinischen Studien mit Namenda traten bei 0,2% der mit Namenda und 0,5% der mit Placebo behandelten Patienten Anfälle auf.
Urogenitale Bedingungen
Bedingungen, die den pH-Wert des Urins erhöhen, können die Ausscheidung von Memantin im Urin verringern, was zu erhöhten Plasmaspiegeln von Memantin führt.
Besondere Bevölkerungsgruppen
Leberfunktionsstörung
Namenda unterliegt einem partiellen Leberstoffwechsel, wobei etwa 48% der verabreichten Dosis als unverändertes Arzneimittel oder als Summe aus Ausgangsarzneimittel und N-Glucuronid-Konjugat (74%) im Urin ausgeschieden werden. Die Pharmakokinetik von Memantin bei Patienten mit eingeschränkter Leberfunktion wurde nicht untersucht, es ist jedoch zu erwarten, dass sie nur geringfügig beeinflusst wird.
Nierenfunktionsstörung
Bei Patienten mit leichter oder mäßiger Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Bei Patienten mit schwerer Nierenfunktionsstörung wird eine Dosisreduktion empfohlen (vgl KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ).
Arzneimittel-Wechselwirkungen
N-Methyl-D-Aspartat (NMDA) Antagonisten: Die kombinierte Anwendung von Namenda mit anderen NMDA-Antagonisten (Amantadin, Ketamin und Dextromethorphan) wurde nicht systematisch evaluiert und sollte mit Vorsicht angegangen werden.
Auswirkungen von Namenda auf Substrate mikrosomaler Enzyme: In-vitro-Studien mit Markersubstraten von CYP450-Enzymen (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) zeigten eine minimale Hemmung dieser Enzyme durch Memantin. In-vitro-Studien haben außerdem gezeigt, dass Memantin bei Konzentrationen, die die mit der Wirksamkeit verbundenen Konzentrationen überschreiten, die Cytochrom-P450-Isozyme CYP1A2, CYP2C9, CYP2E1 und CYP3A4 / 5 nicht induziert. Es sind keine pharmakokinetischen Wechselwirkungen mit Arzneimitteln zu erwarten, die durch diese Enzyme metabolisiert werden.
Auswirkungen von Inhibitoren und / oder Substraten mikrosomaler Enzyme auf Namenda: Memantin wird überwiegend renal eliminiert, und es wird nicht erwartet, dass Arzneimittel, die Substrate und / oder Inhibitoren des CYP450-Systems sind, den Metabolismus von Memantin verändern.
Acetylcholinesterase (AChE) -Hemmer: Die gleichzeitige Verabreichung von Namenda mit dem AChE-Inhibitor Donepezil HCl hatte keinen Einfluss auf die Pharmakokinetik der beiden Verbindungen. In einer 24-wöchigen kontrollierten klinischen Studie wurde bei Patienten mit mittelschwerer bis schwerer Alzheimer-Krankheit die Nebenwirkung festgestellt Das mit einer Kombination von Memantin und Donepezil beobachtete Ereignisprofil war dem von Donepezil allein ähnlich.
Medikamente werden über Nierenmechanismen ausgeschieden: Da Memantin teilweise durch tubuläre Sekretion eliminiert wird, ist die gleichzeitige Verabreichung von Arzneimitteln, die dasselbe kationische Nierensystem verwenden, einschließlich Hydrochlorothiazid (HCTZ), Triamteren (TA), Metformin, Cimetidin, Ranitidin, Chinidin und Nikotin können möglicherweise zu veränderten Plasmaspiegeln führen von beiden Agenten. Die gleichzeitige Verabreichung von Namenda und HCTZ / TA hatte jedoch keinen Einfluss auf die Bioverfügbarkeit von Memantin oder TA, und die Bioverfügbarkeit von HCTZ verringerte sich um 20%. Darüber hinaus hatte die gleichzeitige Anwendung von Memantin mit dem antihyperglykämischen Arzneimittel Glucovance® (Glyburid und Metformin-HCl) keinen Einfluss auf die Pharmakokinetik von Memantin, Metformin und Glyburid. Darüber hinaus veränderte Memantin die Glukose senkende Wirkung von Glucovance® im Serum nicht.
Drogen, die den Urin alkalisch machen: Die Clearance von Memantin wurde unter alkalischen Urinbedingungen bei pH 8 um etwa 80% verringert. Daher können Änderungen des Urin-pH-Werts in Richtung des alkalischen Zustands zu einer Akkumulation des Arzneimittels mit einer möglichen Zunahme der Nebenwirkungen führen. Der pH-Wert des Urins wird durch die Ernährung, Arzneimittel (z. B. Carboanhydrase-Hemmer, Natriumbicarbonat) und den klinischen Zustand des Patienten (z. B. renale tubuläre Azidose oder schwere Infektionen der Harnwege) verändert. Daher sollte Memantine unter diesen Bedingungen mit Vorsicht angewendet werden.
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
In einer 113-wöchigen oralen Studie an Mäusen mit Dosen von bis zu 40 mg / kg / Tag (10-fache der empfohlenen Höchstdosis beim Menschen [MRHD] auf mg / m 2 -Basis) wurde keine Karzinogenität festgestellt. Es gab auch keine Hinweise auf Karzinogenität bei Ratten, denen 71 Wochen lang eine orale Dosis von bis zu 40 mg / kg / Tag verabreicht worden war gefolgt von 20 mg / kg / Tag (20- bzw. 10-fache MRHD, bezogen auf mg / m 2) über 128 Wochen.
Memantin zeigte bei der Auswertung in vitro kein genotoxisches Potential. Typhimurium oder E. Coli Reverse Mutation Assay, ein In-vitro-Chromosomenaberrationstest in menschlichen Lymphozyten, ein In-vivo-Zytogenetik-Assay für Chromosomenschäden bei Ratten und der In-vivo-Maus-Mikronukleus-Assay. Die Ergebnisse waren in einem In-vitro-Genmutationstest unter Verwendung von Chinese Hamster V79-Zellen nicht eindeutig.
Bei Ratten, denen bis zu 18 mg / kg / Tag verabreicht wurden (9 - fache MRHD an einem Tag), wurden keine Beeinträchtigungen der Fertilität oder der Fortpflanzungsfähigkeit beobachtet 14 Tage vor der Paarung durch Trächtigkeit und Laktation bei weiblichen Tieren oder 60 Tage vor der Paarung bei weiblichen Tieren Männer.
Schwangerschaft
Schwangerschaftskategorie B: Oral an trächtige Ratten und trächtige Kaninchen verabreichte Memantin war bis zu den höchsten getesteten Dosen nicht teratogen (18 mg / kg / Tag bei Ratten und 30 mg / kg / Tag bei Kaninchen, was dem 9-fachen bzw. 30-fachen der empfohlenen Höchstdosis beim Menschen [MRHD] in mg / m 2 entspricht Basis).
Leichte maternale Toxizität, verringertes Pup-Gewicht und eine erhöhte Inzidenz von nicht verknöcherten Halswirbeln wurden bei oraler Verabreichung beobachtet Dosis von 18 mg / kg / Tag in einer Studie, in der Ratten mit oraler Gabe von Memantin begonnen und postpartal fortgesetzt wurden Zeitraum. Eine leichte maternale Toxizität und ein verringertes Gewicht der Welpen wurden bei dieser Dosis auch in einer Studie beobachtet, in der Ratten vom 15. Schwangerschaftstag bis zur postpartalen Periode behandelt wurden. Die wirkungslose Dosis für diese Wirkungen betrug 6 mg / kg, was dem 3-fachen der MRHD auf mg / m 2 -Basis entspricht.
Es liegen keine ausreichenden und gut kontrollierten Studien zu Memantin bei Schwangeren vor. Memantine sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Es ist nicht bekannt, ob Memantin in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch übergehen, ist bei der Verabreichung von Memantin an eine stillende Mutter Vorsicht geboten.
Pädiatrische Verwendung
Es gibt keine ausreichenden und gut kontrollierten Studien, die die Sicherheit und Wirksamkeit von Memantin bei Erkrankungen von Kindern belegen.
Nebenwirkungen
Die in diesem Abschnitt beschriebenen Erfahrungen stammen aus Studien an Patienten mit Alzheimer-Krankheit und vaskulärer Demenz.
Unerwünschte Ereignisse, die zur Einstellung führen: In placebokontrollierten Studien, in denen Demenzpatienten Dosen von Namenda bis zu 20 mg / Tag erhielten, wurde die Die Wahrscheinlichkeit eines Abbruchs aufgrund eines unerwünschten Ereignisses war in der Namenda-Gruppe dieselbe wie in der Placebo-Gruppe Gruppe. Bei 1% oder mehr der mit Namenda behandelten Patienten und mit einer höheren Rate als Placebo war kein individuelles unerwünschtes Ereignis mit dem Absetzen der Behandlung verbunden.
In kontrollierten Studien gemeldete unerwünschte Ereignisse: Die in Studien mit Namenda (Memantinhydrochlorid) gemeldeten unerwünschten Ereignisse spiegeln die Erfahrungen wider, die unter engmaschig überwachten Bedingungen bei einer hoch ausgewählten Patientenpopulation gesammelt wurden. In der Praxis oder in anderen klinischen Studien gelten diese Häufigkeitsschätzungen möglicherweise nicht, da sich die Verwendungsbedingungen, das Meldeverhalten und die Arten der behandelten Patienten unterscheiden können. In Tabelle 1 sind die Anzeichen und Symptome aufgeführt, die bei mindestens 2% der Patienten unter Placebo-Kontrolle aufgetreten sind Demenzstudien, bei denen die Häufigkeit des Auftretens bei mit Namenda behandelten Patienten höher war als bei denen, die mit Namenda behandelt wurden Placebo. Bei einer Häufigkeit von mindestens 5% und der doppelten Placeborate trat kein unerwünschtes Ereignis auf.
Körper System |
Placebo (N = 922) % |
Namenda (N = 940) % |
Körper als Ganzes | ||
Ermüden |
1 | 2 |
Schmerzen |
1 | 3 |
Herz-Kreislauf-System | ||
Hypertonie |
2 | 4 |
Zentrales und peripheres Nervensystem | ||
Schwindel |
5 | 7 |
Kopfschmerzen |
3 | 6 |
Magen-Darm-System | ||
Verstopfung |
3 | 5 |
Erbrechen |
2 | 3 |
Bewegungsapparat | ||
Rückenschmerzen |
2 | 3 |
Psychische Störungen | ||
Verwechslung |
5 | 6 |
Schläfrigkeit |
2 | 3 |
Halluzination |
2 | 3 |
Atmungssystem | ||
Husten |
3 | 4 |
Dyspnoe |
1 | 2 |
Andere unerwünschte Ereignisse, die bei mit Namenda behandelten Patienten mit einer Inzidenz von mindestens 2% auftraten, jedoch bei Placebo mit einer größeren oder gleichen Häufigkeit auftraten, waren Erregung, Sturz, zugefügte Verletzung, Harninkontinenz, Durchfall, Bronchitis, Schlaflosigkeit, Harnwegsinfektion, grippeähnliche Symptome, abnormer Gang, Depression, Infektion der oberen Atemwege, Angstzustände, periphere Ödeme, Übelkeit, Anorexie und Arthralgie.
Das Gesamtprofil der unerwünschten Ereignisse und die Inzidenzraten für einzelne unerwünschte Ereignisse bei der Subpopulation von Patienten mit Die mittelschwere bis schwere Alzheimer-Krankheit unterschied sich nicht von den oben beschriebenen Profil- und Inzidenzraten für die gesamte Demenz Population.
Vitalzeichenänderungen: Die Namenda- und Placebo-Gruppen wurden im Hinblick auf die (1) mittlere Veränderung der Vitalparameter (Puls, systolischer Blutdruck, diastolisches Blut) gegenüber dem Ausgangswert verglichen Druck und Gewicht) und (2) die Inzidenz von Patienten, die Kriterien für potenziell klinisch signifikante Veränderungen gegenüber dem Ausgangswert erfüllen Variablen. Bei Patienten, die mit Namenda behandelt wurden, gab es keine klinisch wichtigen Veränderungen der Vitalfunktionen. Ein Vergleich von Rückenlage- und Standvitalzeichenmessungen für Namenda und Placebo bei älteren normalen Probanden ergab, dass die Namenda-Behandlung nicht mit orthostatischen Veränderungen verbunden ist.
Laboränderungen: Namenda - und Placebo - Gruppen wurden in Bezug auf (1) die mittlere Veränderung gegenüber dem Ausgangswert in verschiedenen Bereichen der Serumchemie, Hämatologie und Pharmakologie verglichen Urinanalysevariablen und (2) die Inzidenz von Patienten, die Kriterien für potenziell klinisch signifikante Änderungen gegenüber dem Ausgangswert erfüllen Variablen. Diese Analysen ergaben keine klinisch bedeutsamen Änderungen der Labortestparameter im Zusammenhang mit der Namenda-Behandlung.
EKG-Änderungen: Die Namenda- und Placebo-Gruppen wurden in Bezug auf (1) die mittlere Änderung der verschiedenen EKG-Parameter gegenüber dem Ausgangswert und (2) verglichen. Die Inzidenz von Patienten, die Kriterien für potenziell klinisch signifikante Änderungen gegenüber dem Ausgangswert erfüllen Variablen. Diese Analysen ergaben keine klinisch wichtigen Änderungen der EKG-Parameter, die mit der Namenda-Behandlung verbunden waren.
Andere unerwünschte Ereignisse, die in klinischen Studien beobachtet wurden
Namenda wurde an ungefähr 1350 Patienten mit Demenz verabreicht, von denen mehr als 1200 die empfohlene Höchstdosis von 20 mg / Tag erhielten. Die Patienten erhielten eine Namenda-Behandlung für Zeiträume von bis zu 884 Tagen, wobei 862 Patienten mindestens 24 Behandlungswochen und 387 Patienten mindestens 48 Behandlungswochen erhielten.
Während der Behandlung traten Anzeichen und Symptome auf, die in 8 kontrollierten klinischen Studien und 4 offenen Studien auftraten Studien wurden von den klinischen Prüfärzten unter Verwendung einer eigenen Terminologie als unerwünschte Ereignisse aufgezeichnet wählen. Um eine Gesamtschätzung des Anteils von Personen mit ähnlichen Ereignistypen zu erhalten, wurden die Ereignisse gruppiert unter Verwendung der WHO-Terminologie in eine kleinere Anzahl standardisierter Kategorien eingeteilt und Ereignishäufigkeiten über alle berechnet Studien.
Alle unerwünschten Ereignisse, die bei mindestens zwei Patienten auftreten, sind eingeschlossen, mit Ausnahme der bereits in Tabelle 1 aufgeführten, ebenfalls in der WHO verwendeten Allgemein informativ zu sein, geringfügige Symptome oder Ereignisse, von denen unwahrscheinlich ist, dass sie durch Medikamente verursacht werden, z. B. weil sie in der Studie häufig sind Population. Ereignisse werden nach Körpersystemen klassifiziert und unter Verwendung der folgenden Definitionen aufgelistet: Häufige unerwünschte Ereignisse - solche, die bei mindestens 1/100 Patienten auftreten; seltene unerwünschte Ereignisse - solche, die bei 1/100 bis 1/1000 Patienten auftreten. Diese unerwünschten Ereignisse stehen nicht notwendigerweise im Zusammenhang mit der Namenda-Behandlung und wurden in den kontrollierten Studien in den meisten Fällen in ähnlicher Häufigkeit bei mit Placebo behandelten Patienten beobachtet.
Körper als Ganzes: Häufig: Synkope. Selten: Unterkühlung, allergische Reaktion.
Herz-Kreislauf-System: Häufig: Herzversagen. Selten: Angina pectoris, Bradykardie, Myokardinfarkt, Thrombophlebitis, Vorhofflimmern, Hypotonie, Herzstillstand, posturale Hypotonie, Lungenembolie, Lungenödem.
Zentrales und peripheres Nervensystem: Häufig: vorübergehender ischämischer Anfall, zerebrovaskulärer Unfall, Schwindel, Ataxie, Hypokinese. Selten: Parästhesien, Krämpfe, extrapyramidale Störungen, Hypertonie, Tremor, Aphasie, Hypästhesie, abnormal Koordination, Hemiplegie, Hyperkinesie, unwillkürliche Muskelkontraktionen, Stupor, Gehirnblutung, Neuralgie, Ptosis, Neuropathie.
Magen-Darm-System: Selten: Gastroenteritis, Divertikulitis, gastrointestinale Blutung, Melena, Ösophagusulzeration.
Hemische und Lymphatische Störungen: Häufig: Anämie. Selten: Leukopenie.
Stoffwechsel- und Ernährungsstörungen: Häufig: erhöhte alkalische e Phosphatase, verringertes Gewicht. Selten: Dehydration, Hyponatriämie, verstärkter Diabetes mellitus.
Psychische Störungen: Häufig: aggressive Reaktion. In seltenen Fällen: Wahnvorstellungen, Persönlichkeitsstörungen, emotionale Labilität, Nervosität, Schlafstörungen, erhöhte Libido, Psychose, Amnesie, Apathie, paranoide Reaktion, Denken abnormal, Weinen abnormal, Appetit erhöht, Paronirie, Delirium, Depersonalisation, Neurose, Selbstmord Versuch.
Atmungssystem: Häufig: Lungenentzündung. Selten: Apnoe, Asthma, Hämoptyse.
Haut und Anhänge: Häufig: Hautausschlag. Selten: Hautgeschwüre, Juckreiz, Cellulitis, Ekzeme, Dermatitis, erythematöser Ausschlag, Alopezie, Urtikaria.
Besondere Sinne: Häufig: Katarakt, Bindehautentzündung. Selten: Makula-Lutea-Degeneration, verminderte Sehschärfe, vermindertes Gehör, Tinnitus, Blepharitis, verschwommenes Sehen, Hornhauttrübung, Glaukom, Bindehautblutung, Augenschmerzen, Netzhautblutung, Xerophthalmie, Diplopie, abnormale Tränenfluss, Myopie, Netzhautablösung.
Harnsystem: Häufig: häufige Miktion. Selten: Dysurie, Hämaturie, Harnverhalt.
Berichterstattung nach der Vermarktung von Namenda in den USA und außerhalb der USA
Obwohl kein kausaler Zusammenhang mit der Behandlung mit Memantin festgestellt wurde, wurde berichtet, dass die folgenden unerwünschten Ereignisse zeitlich mit der Behandlung mit Memantin verbunden sind und nicht an anderer Stelle in der Kennzeichnung beschrieben: atrioventrikuläre Blockade, Knochenbruch, Karpaltunnelsyndrom, Hirninfarkt, Schmerzen in der Brust, Claudicatio, Kolitis, Dyskinesie, Dysphagie, Gastritis, gastroösophagealer Reflux, Grand-Mal-Krämpfe, intrakranielle Blutung, Leberversagen, Hyperlipidämie, Hypoglykämie, Ileus, Impotenz, Unwohlsein, malignes neuroleptisches Syndrom, akut Pankreatitis, Aspirationspneumonie, akutes Nierenversagen, verlängertes QT-Intervall, Unruhe, Stevens-Johnson-Syndrom, plötzlicher Tod, supraventrikuläre Tachykardie, Tachykardie, Spätfolgen Dyskinesie und Thrombozytopenie.
TIERISCHE TOXIKOLOGIE
Memantin-induzierte neuronale Läsionen (Vakuolisierung und Nekrose) in den multipolaren und pyramidalen Zellen in den kortikalen Schichten III und IV des posterioren cinguläre und retrospleniale Neocortices bei Ratten, ähnlich denen, von denen bekannt ist, dass sie bei Nagetieren auftreten, denen andere NMDA-Rezeptorantagonisten verabreicht wurden. Läsionen wurden nach einer Einzeldosis von Memantin gesehen. In einer Studie, in der Ratten 14 Tage lang täglich orale Dosen von Memantin verabreicht wurden, betrug die wirkungslose Dosis für neuronale Nekrose das 6-fache der empfohlenen Höchstdosis beim Menschen, bezogen auf mg / m 2. Das Potenzial für die Induktion von zentraler neuronaler Vakuolisierung und Nekrose durch NMDA-Rezeptorantagonisten beim Menschen ist unbekannt.
Drogenmissbrauch und Abhängigkeit
Kontrollierte Stoffklasse: Memantin HCl ist keine kontrollierte Substanz.
Physische und psychische Abhängigkeit: Memantin HCl ist ein nicht-kompetitiver NMDA-Antagonist mit niedriger bis mäßiger Affinität, der keine Hinweise auf eine Drogensuche ergab Verhalten oder Entzugssymptome nach Absetzen bei 2.504 Patienten, die an klinischen Studien zur Therapie teilgenommen haben Dosen. Post-Marketing-Daten außerhalb der USA, die nachträglich erhoben wurden, haben keinen Hinweis auf Drogenmissbrauch oder Drogenabhängigkeit geliefert.
Überdosis
Da sich die Strategien für das Management von Überdosierungen ständig weiterentwickeln, ist es ratsam, sich an a zu wenden Giftkontrollzentrum, um die neuesten Empfehlungen für die Behandlung einer Überdosis von allen zu bestimmen Droge.
Wie in allen Fällen einer Überdosierung sollten allgemeine unterstützende Maßnahmen ergriffen werden und die Behandlung sollte symptomatisch sein. Die Elimination von Memantin kann durch Ansäuern des Urins verbessert werden. In einem dokumentierten Fall einer Überdosierung mit bis zu 400 mg Memantin erlitt der Patient Unruhe, Psychose, visuelle Halluzinationen, Schläfrigkeit, Benommenheit und Bewusstlosigkeit. Der Patient erholte sich ohne bleibende Folgen.
Dosierung und Anwendung
Die in kontrollierten klinischen Studien nachgewiesene wirksame Dosierung von Namenda (Memantinhydrochlorid) beträgt 20 mg / Tag.
Die empfohlene Anfangsdosis von Namenda beträgt 5 mg einmal täglich. Die empfohlene Zieldosis beträgt 20 mg / Tag. Die Dosis sollte in Schritten von 5 mg auf 10 mg / Tag (5 mg zweimal täglich), 15 mg / Tag (5 mg und 10 mg in getrennten Dosen) und 20 mg / Tag (10 mg zweimal täglich) erhöht werden. Das empfohlene Mindestintervall zwischen den Dosiserhöhungen beträgt eine Woche.
Namenda kann unabhängig von den Mahlzeiten eingenommen werden.
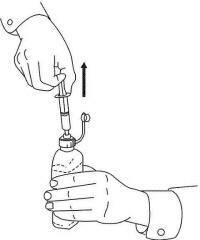
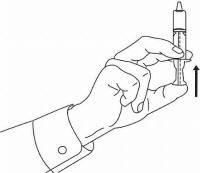
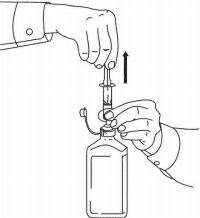
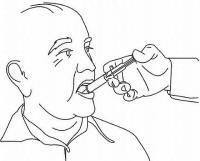
Patienten / Pflegekräfte sollten in die Anwendung des Dosiergeräts Namenda Oral Solution eingewiesen werden. Sie sollten auf das dem Produkt beiliegende Patientenanweisungsblatt aufmerksam gemacht werden. Patienten / Betreuer sollten angewiesen werden, Fragen zur Verwendung der Lösung an ihren Arzt oder Apotheker zu richten.
Dosen in speziellen Populationen
Bei Patienten mit schwerer Nierenfunktionsstörung wird eine Zieldosis von 5 mg BID empfohlen (Kreatinin-Clearance von 5 - 29 ml / min basierend auf der Cockroft-Gault-Gleichung):
Für Männer: CLcr = [140 Jahre] · Gewicht (kg) / [72 · Serumkreatinin (mg / dl)]
Für Frauen: CLcr = 0,85 · [140 Jahre] · Gewicht (kg) / [72 · Serumkreatinin (mg / dl)]
Wie geliefert
5 mg Tablette:
Flasche mit 60 NDC # 0456-3205-60
10 × 10 Einheitsdosis NDC # 0456-3205-63
Die kapselförmigen Filmtabletten sind braun, wobei die Stärke (5) auf der einen Seite und FL auf der anderen Seite geprägt ist.
10 mg Tablette:
Flasche mit 60 NDC # 0456-3210-60
10 × 10 Einheitsdosis NDC # 0456-3210-63
Die kapselförmigen Filmtabletten sind grau, wobei die Stärke (10) auf der einen Seite und FL auf der anderen Seite geprägt ist.
Titration Pak:
PVC / Aluminium-Blisterpackung mit 49 Tabletten. 28 × 5 mg und 21 × 10 mg Tabletten. NDC # 0456-3200-14
Die 5 mg kapselförmigen Filmtabletten sind braun, wobei die Stärke (5) auf der einen Seite und FL auf der anderen Seite geprägt ist. Die 10 mg-Filmtabletten in Form von Kapseln sind grau, wobei die Stärke (10) auf der einen Seite und FL auf der anderen Seite geprägt ist.
Mündliche Lösung:
Die Dosierungsempfehlungen für die Lösung zum Einnehmen sind die gleichen wie für Tabletten. Die Lösung zum Einnehmen ist klar, alkoholfrei, zuckerfrei und mit Pfefferminzgeschmack.
2 mg / ml Lösung zum Einnehmen (10 mg = 5 ml)
12 fl. oz. (360 ml) Flasche NDC # 0456-3202-12
Bei 25 ° C lagern. zulässige Exkursionen bis 15-30 ° C (59-86 ° F) [siehe USP Controlled Room Temperature].
Forest Pharmaceuticals, Inc.
Tochtergesellschaft von Forest Laboratories, Inc.
St. Louis, MO 63045
Lizenziert von der Merz Pharmaceuticals GmbH
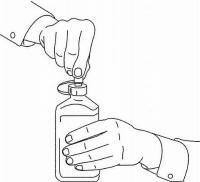
PATIENTENANLEITUNG FÜR NAMENDA® Oral Solution
Befolgen Sie die nachstehenden Anweisungen, um Ihr Namenda® Oral Solution-Dosiergerät zu verwenden.
WICHTIG: Lesen Sie diese Anweisungen, bevor Sie Namenda® Oral Solution verwenden.
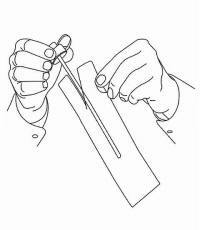 |
|
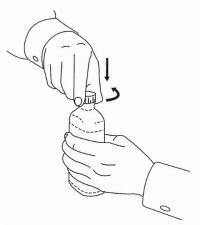 |
|
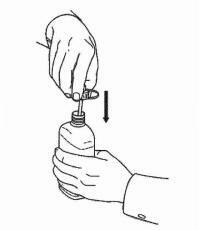 |
|
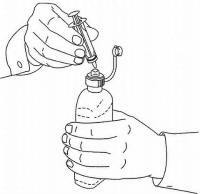 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
WICHTIG: Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Letzte Aktualisierung 4/07.
Quelle: Forest Laboratories, US-Distributor von Namenda.
Namenda Patienteninformation (in Klartext)
zurück zu: Psychiatrische Medikamente Pharmakologie Homepage



