Nuvigil: Übermäßige Schläfrigkeitsbehandlung (vollständige Verschreibungsinformationen)
Markenname: Nuvigil
Gattungsname: Armodafinil
Nuvigil® (Armodafinil) -Tabletten [C-IV]
Armodafinil ist ein Medikament zur Förderung der Wachsamkeit, das als Nuvigil zur Behandlung von Schlafapnoe, Narkolepsie oder Schlafstörungen bei Schichtarbeit erhältlich ist. Anwendung, Dosierung, Nebenwirkungen.
Inhalt:
Beschreibung
Klinische Pharmakologie
Klinische Versuche
Indikationen und Verwendung
Kontraindikationen
Warnungen
Vorsichtsmaßnahmen
Nebenwirkungen
Drogenmissbrauch und Abhängigkeit
Überdosis
Dosierung und Anwendung
Wie geliefert
Nuvigil Patienteninformationsblatt (in reinem Englisch)
Beschreibung
NUVIGIL® (Armodafinil) ist ein wachheitsförderndes Mittel zur oralen Verabreichung. Armodafinil ist das R-Enantiomer von Modafinil, einem Gemisch der R- und S-Enantiomere. Die chemische Bezeichnung für Armodafinil lautet 2 - [(R) - (Diphenylmethyl) sulfinyl] acetamid. Die Summenformel lautet C.15H15NEIN2S und das Molekulargewicht beträgt 273,35.
Die chemische Struktur ist:
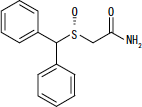
Armodafinil ist ein weißes bis cremefarbenes kristallines Pulver, das in Wasser sehr schwer löslich, in Aceton schwer löslich und in Methanol löslich ist. NUVIGIL-Tabletten enthalten 50, 150 oder 250 mg Armodafinil und die folgenden inaktiven Inhaltsstoffe: Croscarmellose Natrium, Lactosemonohydrat, Magnesiumstearat, mikrokristalline Cellulose, Povidon und vorgelatiniert Stärke.
oben
Klinische Pharmakologie
Wirkmechanismus und Pharmakologie
Die genauen Mechanismen, über die Armodafinil (R-Enantiomer) oder Modafinil (Gemisch aus R- und S-Enantiomeren) die Wachsamkeit fördern, sind nicht bekannt. Sowohl Armodafinil als auch Modafinil haben in nichtklinischen Tier- und In-vitro-Studien im getesteten Umfang ähnliche pharmakologische Eigenschaften gezeigt.
Fortsetzung der Geschichte unten
In pharmakologisch relevanten Konzentrationen bindet oder hemmt Armodafinil nicht an mehrere Rezeptoren und Enzyme, die möglicherweise für relevant sind Schlaf / Wach-Regulation, einschließlich derer für Serotonin, Dopamin, Adenosin, Galanin, Melatonin, Melanocortin, Orexin-1, Orphanin, PACAP oder Benzodiazepine oder Transporter für GABA, Serotonin, Noradrenalin und Cholin oder Phosphodiesterase VI, COMT, GABA-Transaminase und Tyrosin Hydroxylase. Modafinil hemmt nicht die Aktivität von MAO-B oder Phosphodiesterasen II-IV.
Modafinil-induzierte Wachsamkeit kann durch den Î ± 1-adrenergen Rezeptor-Antagonisten Prazosin abgeschwächt werden; Modafinil ist jedoch in anderen In-vitro-Testsystemen inaktiv, von denen bekannt ist, dass sie auf Î ± -adrenerge Agonisten wie das Ratten-Vas-deferens-Präparat ansprechen.
Armodafinil ist kein direkt oder indirekt wirkender Dopaminrezeptoragonist. In vitro binden jedoch sowohl Armodafinil als auch Modafinil an den Dopamintransporter und hemmen die Dopaminwiederaufnahme. Für Modafinil wurde diese Aktivität in vivo mit erhöhten extrazellulären Dopaminspiegeln in einigen Hirnregionen von Tieren in Verbindung gebracht. Bei gentechnisch veränderten Mäusen, denen der Dopamintransporter (DAT) fehlte, fehlte Modafinil die wachfördernde Aktivität, was darauf hindeutet, dass diese Aktivität DAT-abhängig war. Im Gegensatz zu Amphetamin wirkte Modafinil jedoch nicht gegen den Dopaminrezeptor-Antagonisten Haloperidol bei Ratten.
Zusätzlich blockiert Alpha-Methyl-p-Tyrosin, ein Inhibitor der Dopaminsynthese, die Wirkung von Amphetamin, blockiert jedoch nicht die durch Modafinil induzierte Bewegungsaktivität.
Armodafinil und Modafinil haben wachfördernde Wirkungen, die Sympathomimetika wie Amphetamin ähneln und Methylphenidat, obwohl ihr pharmakologisches Profil nicht mit dem des Sympathomimetikums identisch ist Amine. Zusätzlich zu seiner wachfördernden Wirkung und seiner Fähigkeit, die Bewegungsaktivität bei Tieren zu steigern, produziert Modafinil Psychoaktive und euphorische Effekte, Veränderungen der Stimmung, Wahrnehmung, des Denkens und der Gefühle, die für andere ZNS-Stimulanzien typisch sind in Menschen. Modafinil hat verstärkende Eigenschaften, wie seine Selbstverabreichung bei Affen zeigt, die zuvor für die Selbstverabreichung von Kokain geschult wurden. Modafinil wurde auch teilweise als stimulanzienartig diskriminiert.
Basierend auf nichtklinischen Studien scheinen zwei Hauptmetaboliten, Säure und Sulfon, von Modafinil oder Armodafinil, nicht zu den ZNS-aktivierenden Eigenschaften der Ausgangsverbindungen beizutragen.
Pharmakokinetik
Die aktive Komponente von NUVIGIL ist Armodafinil, das längerlebige Enantiomer von Modafinil. NUVIGIL zeigt nach einmaliger und mehrfacher oraler Verabreichung eine lineare, zeitunabhängige Kinetik. Die Zunahme der systemischen Exposition ist proportional über den Dosisbereich von 50 bis 400 mg. Während der 12-wöchigen Dosierung wurde keine zeitabhängige Änderung der Kinetik beobachtet. Der scheinbare stationäre Zustand von NUVIGIL wurde innerhalb von 7 Tagen nach der Dosierung erreicht. Im Steady State beträgt die systemische Exposition gegenüber NUVIGIL das 1,8-fache der Exposition, die nach einer Einzeldosis beobachtet wird. Die Konzentrations-Zeit-Profile des reinen R-Enantiomers nach Verabreichung von 50 mg NUVIGIL oder 100 mg PROVIGIL® (Modafinil) sind nahezu überlagernd.
Absorption
NUVIGIL wird nach oraler Verabreichung leicht resorbiert. Die absolute orale Bioverfügbarkeit wurde aufgrund der Wasserunlöslichkeit von Armodafinil, die eine intravenöse Verabreichung ausschloss, nicht bestimmt. Im nüchternen Zustand werden nach ca. 2 Stunden maximale Plasmakonzentrationen erreicht. Der Lebensmitteleffekt auf die Gesamtbioverfügbarkeit von NUVIGIL wird als minimal angesehen. Zeit bis zum Erreichen der Spitzenkonzentration (tmax) kann sich im gefütterten Zustand um ca. 2-4 Stunden verzögern. Da die Verzögerung in tmax ist auch mit erhöhten Plasmaspiegeln zu einem späteren Zeitpunkt verbunden. Lebensmittel können möglicherweise den Beginn und den zeitlichen Verlauf der pharmakologischen Wirkung von NUVIGIL beeinflussen.
Verteilung
NUVIGIL hat ein scheinbares Verteilungsvolumen von ca. 42 L. Spezifische Daten zur Armodafinil-Proteinbindung liegen nicht vor. Modafinil ist jedoch mäßig an Plasmaprotein (ungefähr 60%) gebunden, hauptsächlich an Albumin. Das Potenzial für Wechselwirkungen von NUVIGIL mit stark proteingebundenen Arzneimitteln wird als gering eingeschätzt.
Stoffwechsel
In-vitro- und In-vivo-Daten zeigen, dass Armodafinil eine hydrolytische Desamidierung, S-Oxidation und Hydroxylierung des aromatischen Rings mit anschließender Glucuronidkonjugation der hydroxylierten Produkte durchläuft. Die Amidhydrolyse ist der am häufigsten vorkommende Stoffwechselweg, wobei die Sulfonbildung durch Cytochrom P450 (CYP) 3A4 / 5 an nächster Stelle steht. Die anderen oxidativen Produkte werden in vitro zu langsam gebildet, um die verantwortlichen Enzyme identifizieren zu können. Nur zwei Metaboliten erreichen nennenswerte Konzentrationen im Plasma (d. H. R-Modafinilsäure und Modafinilsulfon).
Für die NUVIGIL-Disposition spezifische Daten sind nicht verfügbar. Modafinil wird jedoch hauptsächlich über den Metabolismus, hauptsächlich in der Leber, ausgeschieden, wobei weniger als 10% der Ausgangsverbindung im Urin ausgeschieden werden. Insgesamt 81% der verabreichten Radioaktivität wurden 11 Tage nach der Einnahme vorwiegend im Urin (80% gegenüber 1,0% im Kot) wiedergewonnen.
Beseitigung
Nach oraler Verabreichung von NUVIGIL zeigt Armodafinil einen offensichtlichen monoexponentiellen Abfall der maximalen Plasmakonzentration. Der scheinbare Endpunkt t ½ beträgt ungefähr 15 Stunden. Die orale Clearance von NUVIGIL beträgt ca. 33 ml / min.
Arzneimittel-Wechselwirkungen
Das Vorhandensein mehrerer Stoffwechselwege für Armodafinil sowie die Tatsache, dass ein nicht mit CYP in Zusammenhang stehender Stoffwechselweg bei der Metabolisierung von Armodafinil am schnellsten ist, legen nahe, dass aufgrund der gleichzeitigen CYP-Hemmung eine geringe Wahrscheinlichkeit besteht, dass wesentliche Auswirkungen auf das pharmakokinetische Gesamtprofil von NUVIGIL vorliegen Medikamente.
In-vitro-Daten zeigten, dass Armodafinil eine schwache induktive Reaktion auf CYP1A2 und möglicherweise CYP3A zeigt Aktivitäten in konzentrationsbezogener Weise und die CYP2C19-Aktivität wird reversibel gehemmt durch Armodafinil. Andere CYP-Aktivitäten schienen von Armodafinil nicht betroffen zu sein. Eine In-vitro-Studie zeigte, dass Armodafinil ein Substrat von P-Glykoprotein ist.
Die chronische Gabe von 250 mg NUVIGIL verringerte die systemische Exposition gegenüber Midazolam nach einmaliger oraler Gabe um 32% und um 17% (5 mg) und intravenöse (2 mg) Dosen, was darauf hindeutet, dass die Verabreichung von NUVIGIL CYP3A moderat induziert Aktivität. Medikamente, die Substrate für CYP3A4 / 5 sind, wie Cyclosporin, erfordern möglicherweise eine Dosisanpassung. (Sehen Vorsichtsmaßnahmen, Wechselwirkungen mit anderen Medikamenten).
Die chronische Verabreichung von 250 mg NUVIGIL hatte keinen Einfluss auf die Pharmakokinetik von 200 mg Koffein, einem Sondensubstrat für die CYP1A2-Aktivität.
Die gleichzeitige Anwendung einer Einzeldosis von 400 mg NUVIGIL mit Omeprazol (40 mg) erhöhte die systemische Wirksamkeit Exposition gegenüber Omeprazol um ca. 40%, was darauf hinweist, dass Armodafinil CYP2C19 mäßig hemmt Aktivität. Medikamente, die Substrate für CYP2C19 sind, erfordern möglicherweise eine Dosisreduktion. (Sehen Vorsichtsmaßnahmen, Wechselwirkungen mit anderen Medikamenten).
Gender-Effekt
Eine populationspharmakokinetische Analyse lässt keinen geschlechtsspezifischen Einfluss auf die Pharmakokinetik von Armodafinil erkennen.
Besondere Bevölkerungsgruppen
Armodafinil-spezifische Daten für bestimmte Bevölkerungsgruppen liegen nicht vor.
Alter Wirkung: Eine leichte Abnahme (~ 20%) der oralen Clearance (CL / F) von Modafinil wurde in einer Einzeldosisstudie bei 200 mg von 12 beobachtet Patienten mit einem Durchschnittsalter von 63 Jahren (Bereich 53 - 72 Jahre), die Änderung wurde jedoch als klinisch unwahrscheinlich eingestuft von Bedeutung. In einer Mehrfachdosis-Studie (300 mg / Tag) bei 12 Patienten mit einem Durchschnittsalter von 82 Jahren (Bereich 67 - 87 Jahre) war der Mittelwert Die Modafinil-Spiegel im Plasma waren ungefähr doppelt so hoch wie in früheren Studien bei vergleichbaren jüngeren Themen. Aufgrund möglicher Auswirkungen der mehrfachen gleichzeitigen Einnahme von Medikamenten, mit denen die meisten Patienten behandelt wurden behandelt wird, kann der offensichtliche Unterschied in der Pharmakokinetik von Modafinil nicht allein auf die Wirkungen von Modafinil zurückgeführt werden Altern. Die Ergebnisse deuten jedoch darauf hin, dass die Clearance von Modafinil bei älteren Menschen verringert sein kann (siehe Abschnitt 4.4) Dosierung und Anwendung).
Race Effect: Der Einfluss der Rasse auf die Pharmakokinetik von Modafinil wurde nicht untersucht.
Nierenfunktionsstörung: In einer 200-mg-Modafinil-Einzeldosisstudie trat bei schwerer chronischer Niereninsuffizienz (Kreatinin-Clearance 20 ml / min) keine Störung auf die Pharmakokinetik von Modafinil signifikant beeinflussen, aber die Exposition gegenüber Modafinilsäure war um das 9fache erhöht (vgl Vorsichtsmaßnahmen).
Leberfunktionsstörung: Die Pharmakokinetik und der Metabolismus von Modafinil wurden bei Patienten mit Leberzirrhose (6 Männer und 3 Frauen) untersucht. Drei Patienten hatten eine Zirrhose im Stadium B oder B + und 6 Patienten hatten eine Zirrhose im Stadium C oder C + (gemäß den Child-Pugh-Bewertungskriterien). Klinisch waren 8 von 9 Patienten ikterisch und hatten alle Aszites. Bei diesen Patienten war die orale Clearance von Modafinil um etwa 60% verringert und die Steady-State-Konzentration im Vergleich zu normalen Patienten verdoppelt. Die Dosis von NUVIGIL sollte bei Patienten mit schwerer Leberfunktionsstörung reduziert werden (siehe Abschnitt 4.4) Vorsichtsmaßnahmen und Dosierung und Anwendung).
oben
Klinische Versuche
Die Wirksamkeit von NUVIGIL zur Verbesserung der Wachsamkeit wurde im folgenden Schlaf nachgewiesen Störungen: obstruktives Schlafapnoe / Hypopnoe-Syndrom (OSAHS), Narkolepsie und Schichtarbeitsschlafstörung (SWSD).
Für jede klinische Studie war ein p-Wert von 0,05 für die statistische Signifikanz erforderlich.
Obstruktives Schlafapnoe / Hypopnoe-Syndrom (OSAHS)
Die Wirksamkeit von NUVIGIL bei der Verbesserung der Wachsamkeit bei Patienten mit übermäßiger Schläfrigkeit im Zusammenhang mit OSAHS wurde in nachgewiesen zwei 12-wöchige, multizentrische, placebokontrollierte, doppelblinde Parallelgruppenstudien mit ambulanten Patienten, die die Internationale getroffen haben Klassifikation von Schlafstörungen (ICSD) Kriterien für OSAHS (die auch mit der American Psychiatric Association übereinstimmen) DSM-IV-Kriterien). Diese Kriterien umfassen entweder 1) übermäßige Schläfrigkeit oder Schlaflosigkeit sowie häufige Episoden von Beeinträchtigungen Atmung im Schlaf und damit verbundene Merkmale wie lautes Schnarchen, morgendliche Kopfschmerzen oder Mundtrockenheit Erwachen; oder 2) übermäßige Schläfrigkeit oder Schlaflosigkeit; und Polysomnographie, die eine der folgenden Eigenschaften aufweist: mehr als fünf obstruktive Apnoen mit einer Dauer von jeweils mehr als 10 Sekunden pro Schlafstunde; und eine oder mehrere der folgenden: häufige Erregungen durch Schlaf in Verbindung mit Apnoen, Bradytachykardie oder arterieller Sauerstoffentsättigung in Verbindung mit Apnoen. Darüber hinaus mussten alle Patienten für den Eintritt in diese Studien übermäßig schläfrig sein, wie gezeigt wurde trotz Behandlung mit kontinuierlichem positivem Atemwegsdruck um eine Punktzahl von 10 auf der Epworth-Schläfrigkeitsskala (CPAP). Der Nachweis, dass CPAP bei der Reduzierung von Apnoe- / Hypopnoe-Episoden wirksam war, war zusammen mit der Dokumentation der CPAP-Anwendung erforderlich.
Die Patienten mussten CPAP-konform sein, definiert als CPAP-Nutzung 4 Stunden / Nacht in 70% der Nächte. Die CPAP-Anwendung wurde während der gesamten Studie fortgesetzt. In beiden Studien waren die Hauptindikatoren für die Wirksamkeit 1) die Schlaflatenz, die durch den Wachsamkeitstest (MWT) ermittelt wurde. und 2) die Änderung des Gesamtkrankheitsstatus des Patienten, gemessen durch den klinischen globalen Eindruck der Änderung (CGI-C) am Ende Besuch. Für einen erfolgreichen Versuch mussten beide Maßnahmen eine statistisch signifikante Verbesserung zeigen.
Die MWT misst die Latenz (in Minuten) zum Einschlafen. Eine erweiterte MWT wurde mit Testsitzungen im Abstand von 2 Stunden zwischen 9.00 und 19.00 Uhr durchgeführt. Die primäre Analyse war der Durchschnitt der Schlaflatenzen aus den ersten vier Testsitzungen (9.00 bis 15.00 Uhr). Bei jeder Testsitzung wurde die Testperson gebeten, zu versuchen, ohne außergewöhnliche Maßnahmen wach zu bleiben. Jede Testsitzung wurde nach 30 Minuten beendet, wenn kein Schlaf auftrat oder unmittelbar nach dem Einsetzen des Schlafes. Der CGI-C ist eine 7-Punkte-Skala, die sich auf No Change konzentriert und von Very Much Worse bis Very Much Improved reicht. Die Evaluatoren erhielten keine spezifischen Leitlinien zu den Kriterien, die sie bei der Bewertung von Patienten anwenden sollten.
In der ersten Studie wurden insgesamt 395 Patienten mit OSAHS randomisiert und erhielten NUVIGIL 150 mg / Tag, NUVIGIL 250 mg / Tag oder ein entsprechendes Placebo. Mit NUVIGIL behandelte Patienten zeigten eine statistisch signifikante Verbesserung der Fähigkeit, wach zu bleiben, im Vergleich zu mit Placebo behandelten Patienten, gemessen anhand der MWT beim letzten Besuch. Eine statistisch signifikant höhere Anzahl von Patienten, die mit NUVIGIL behandelt wurden, zeigten eine Verbesserung des klinischen Gesamtzustands gemäß der CGI-C-Skala beim letzten Besuch. Die durchschnittlichen Schlaflatenzen (in Minuten) in der MWT zu Studienbeginn sind in der nachstehenden Tabelle 1 zusammen mit der durchschnittlichen Änderung der MWT zum Studienbeginn beim letzten Besuch angegeben. Die Prozentsätze der Patienten, die in den klinischen Studien eine Verbesserung des CGI-C zeigten, sind in Tabelle 2 unten aufgeführt. Die beiden Dosen von NUVIGIL bewirkten statistisch signifikante Effekte in ähnlicher Größenordnung auf die MWT und auch auf den CGI-C.
In der zweiten Studie wurden 263 Patienten mit OSAHS entweder mit NUVIGIL 150 mg / Tag oder mit Placebo randomisiert. Mit NUVIGIL behandelte Patienten zeigten eine statistisch signifikante Verbesserung der Fähigkeit, wach zu bleiben, im Vergleich zu mit Placebo behandelten Patienten, gemessen anhand der MWT [Tabelle 1]. Eine statistisch signifikant höhere Anzahl von mit NUVIGIL behandelten Patienten zeigte eine Verbesserung des klinischen Gesamtzustands gemäß der CGI-C-Skala [Tabelle 2].
Der mit der Polysomnographie gemessene Nachtschlaf wurde durch die Anwendung von NUVIGIL in beiden Studien nicht beeinträchtigt.
Narkolepsie
Die Wirksamkeit von NUVIGIL bei der Verbesserung der Wachsamkeit bei Patienten mit übermäßiger Schläfrigkeit (ES) im Zusammenhang mit Narkolepsie wurde festgestellt in einer 12-wöchigen, multizentrischen, placebokontrollierten, doppelblinden Parallelgruppenstudie an ambulanten Patienten, die die ICSD-Kriterien für erfüllten Narkolepsie. Insgesamt 196 Patienten wurden randomisiert und erhielten NUVIGIL 150 oder 250 mg / Tag oder ein passendes Placebo. Die ICSD-Kriterien für Narkolepsie umfassen entweder 1) wiederkehrende Nickerchen am Tag oder Schlafstörungen, die mindestens drei Tage lang fast täglich auftreten Monate plus plötzlicher bilateraler Verlust des Haltungsmuskeltonus in Verbindung mit intensiven Emotionen (Kataplexie) oder 2) einer Beschwerde übermäßige Schläfrigkeit oder plötzliche Muskelschwäche mit zugehörigen Merkmalen: Schlaflähmung, hypnagogische Halluzinationen, automatisches Verhalten, gestörter Major Schlaf-Episode; und Polysomnographie, die eines der folgenden Merkmale zeigt: Schlaflatenz von weniger als 10 Minuten oder REM-Schlaflatenz von Rapid Eye Movement (REM) von weniger als 20 Minuten und Mehrfachschlaf Der Latenztest (MSLT), der eine mittlere Schlaflatenz von weniger als 5 Minuten und zwei oder mehr REM-Perioden mit Schlafbeginn und keine medizinische oder psychische Störung nachweist, erklärt die Symptome. Für die Aufnahme in diese Studien mussten alle Patienten über MSLT objektiv eine übermäßige Schläfrigkeit am Tag dokumentiert haben mit einer Schlaflatenz von 6 Minuten oder weniger und dem Fehlen anderer klinisch signifikanter aktiver medizinischer oder psychiatrischer Patienten Störung. Die MSLT, eine objektive polysomnographische Beurteilung der Fähigkeit des Patienten, in einem Krankenhaus einzuschlafen Nicht stimulierende Umgebung, gemessene Latenz (in Minuten) bis zum Einschlafen, gemittelt über 4 Testsitzungen bei 2-stündige Intervalle. Bei jeder Testsitzung wurde dem Probanden gesagt, er solle ruhig liegen und versuchen zu schlafen. Jede Testsitzung wurde nach 20 Minuten beendet, wenn kein Schlaf auftrat oder unmittelbar nach dem Einsetzen des Schlafes.
Die primären Maßstäbe für die Wirksamkeit waren: 1) Schlaflatenz, wie durch den Maintenance of Wakefulness Test (MWT) bewertet, und 2) die Veränderung der Gesamterkrankung des Patienten Status, gemessen anhand des Clinical Global Impression of Change (CGI-C) beim letzten Besuch (eine Beschreibung finden Sie oben im Abschnitt KLINISCHE STUDIEN, OSAHS oben Maße). Jede MWT-Testsitzung wurde nach 20 Minuten beendet, wenn in dieser Studie kein Schlaf auftrat oder unmittelbar nach dem Einsetzen des Schlafes.
Mit NUVIGIL behandelte Patienten zeigten eine statistisch signifikant verbesserte Fähigkeit, bei jeder Dosis auf der MWT wach zu bleiben, verglichen mit Placebo beim letzten Besuch [Tabelle 1]. Eine statistisch signifikant größere Anzahl von Patienten, die bei jeder Dosis mit NUVIGIL behandelt wurden, zeigte beim letzten Besuch eine Verbesserung des klinischen Gesamtzustands, wie anhand der CGI-C-Skala bewertet [Tabelle 2].
Die beiden Dosen von NUVIGIL erzeugten statistisch signifikante Effekte ähnlicher Größenordnung auf den CGI-C. Obwohl für jede Dosis ein statistisch signifikanter Effekt auf die MWT beobachtet wurde, wurde beobachtet, dass das Ausmaß des Effekts für die höhere Dosis größer war.
Der mit Polysomnographie gemessene Nachtschlaf wurde durch die Verwendung von NUVIGIL nicht beeinträchtigt.
Schichtarbeit Schlafstörung (SWSD)
Die Wirksamkeit von NUVIGIL bei der Verbesserung der Wachsamkeit bei Patienten mit übermäßiger Schläfrigkeit im Zusammenhang mit SWSD wurde in einer 12-wöchigen, multizentrischen, doppelblinden, placebokontrollierten Parallelgruppenklinik nachgewiesen Versuch. Insgesamt 254 Patienten mit chronischer SWSD erhielten randomisiert 150 mg NUVIGIL / Tag oder Placebo. Alle Patienten erfüllten die ICSD-Kriterien für chronische SWSD [die mit den DSM-IV-Kriterien der American Psychiatric Association für Schlafstörungen mit zirkadianem Rhythmus: Schichtarbeitstyp übereinstimmen]. Diese Kriterien umfassen 1) entweder: a) eine Hauptbeschwerde über übermäßige Schläfrigkeit oder Schlaflosigkeit, die zeitlich mit einer Arbeitszeit (normalerweise Nachtarbeit) verbunden ist tritt während der gewohnheitsmäßigen Schlafphase auf, oder b) Polysomnographie und die MSLT zeigen den Verlust eines normalen Schlaf-Wach-Musters (d. h. chronobiologisch gestört) Rhythmizität); und 2) keine andere medizinische oder psychische Störung erklärt die Symptome und 3) die Symptome erfüllen nicht die Kriterien für jede andere Schlafstörung, die Schlaflosigkeit oder übermäßige Schläfrigkeit hervorruft (z. B. Zeitzonenänderung [Jetlag] Syndrom).
Es ist zu beachten, dass nicht alle Patienten mit einer Beschwerde über Schläfrigkeit, die ebenfalls Schichtarbeit leisten, die Kriterien für die Diagnose von SWSD erfüllen. In die klinische Studie wurden nur Patienten eingeschlossen, die mindestens 3 Monate lang symptomatisch waren.
Eingeschriebene Patienten mussten außerdem mindestens 5 Nachtschichten pro Monat arbeiten und hatten eine übermäßige Schläfrigkeit Zeit ihrer Nachtschichten (MSLT-Score - 6 Minuten) und Schlaflosigkeit am Tag durch ein Polysomnogramm am Tag dokumentiert (PSG).
Die Hauptindikatoren für die Wirksamkeit waren 1) die Schlaflatenz, bewertet durch den Multiple Sleep Latency Test (MSLT), durchgeführt während einer simulierten Nachtschicht um der letzte Besuch und 2) die Änderung des allgemeinen Krankheitsstatus des Patienten, gemessen anhand des klinischen globalen Eindrucks der Veränderung (CGI-C) beim letzten Besuch. (Sehen Klinische Versuche, Narkolepsie- und OSAHS-Abschnitte oben zur Beschreibung dieser Maßnahmen).
Patienten, die mit NUVIGIL behandelt wurden, zeigten eine statistisch signifikante Verlängerung der Schlafdauer Beginn im Vergleich zu mit Placebo behandelten Patienten, gemessen anhand der nächtlichen MSLT beim letzten Besuch [Tabelle 1]. Eine statistisch signifikant größere Anzahl von mit NUVIGIL behandelten Patienten zeigte beim letzten Besuch eine Verbesserung des klinischen Gesamtzustands, wie anhand der CGI-C-Skala bewertet [Tabelle 2].
Der mit der Polysomnographie gemessene Tagesschlaf wurde durch die Anwendung von NUVIGIL nicht beeinträchtigt.
| Störung | Messen | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo | |||
* In allen Studien signifikant anders als Placebo (p <0,05) | |||||||
| Basislinie | Veränderung von der Basislinie |
Basislinie | Veränderung von der Basislinie |
Basislinie | Wechsel von Basislinie |
||
| OSAHS I. | MWT | 21.5 | 1.7 | 23.3 | 2.2 | 23.2 | -1.7 |
| OSAHS II | MWT | 23.7 | 2.3 | - | - | 23.3 | -1.3 |
| Narkolepsie | MWT | 12.1 | 1.3 | 9.5 | 2.6 | 12.5 | -1.9 |
| SWSD | MSLT | 2.3 | 3.1 | - | - | 2.4 | 0.4 |
| Störung | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo |
* In allen Studien signifikant anders als Placebo (p <0,05) | |||
| OSAHS I. | 71% | 74% | 37% |
| OSAHS II | 71% | - | 53% |
| Narkolepsie | 69% | 73% | 33% |
| SWSD | 79% | - | 59% |
oben
Indikationen und Verwendung
NUVIGIL ist angezeigt, um die Wachsamkeit bei Patienten mit übermäßiger Schläfrigkeit zu verbessern, die mit obstruktivem Schlafapnoe / Hypopnoe-Syndrom, Narkolepsie und Schlafstörung bei Schichtarbeit verbunden sind.
In OSAHS ist NUVIGIL als Ergänzung zu Standardbehandlungen für die zugrunde liegende Obstruktion angezeigt. Wenn für einen Patienten ein kontinuierlicher positiver Atemwegsdruck (CPAP) die Behandlung der Wahl ist, sollten vor Beginn der Behandlung mit NUVIGIL maximale Anstrengungen unternommen werden, um einen angemessenen Zeitraum mit CPAP zu behandeln. Wenn NUVIGIL zusammen mit CPAP angewendet wird, ist die Förderung und regelmäßige Bewertung der CPAP-Konformität erforderlich.
In allen Fällen ist die sorgfältige Beachtung der Diagnose und Behandlung der zugrunde liegenden Schlafstörung (en) von größter Bedeutung. Verschreiber sollten sich bewusst sein, dass einige Patienten möglicherweise mehr als eine Schlafstörung haben, die zu ihrer übermäßigen Schläfrigkeit beiträgt.
Die Wirksamkeit von NUVIGIL bei Langzeitanwendung (länger als 12 Wochen) wurde in placebokontrollierten Studien nicht systematisch bewertet. Der Arzt, der NUVIGIL für einen längeren Zeitraum bei Patienten verschreibt, sollte den langfristigen Nutzen für den einzelnen Patienten regelmäßig neu bewerten.
oben
Kontraindikationen
NUVIGIL ist bei Patienten mit bekannter Überempfindlichkeit gegen Modafinil und Armodafinil oder seine inaktiven Inhaltsstoffe kontraindiziert.
oben
WARNHINWEISE
Schwerer Hautausschlag, einschließlich Stevens-Johnson-Syndrom
Bei Erwachsenen wurde im Zusammenhang mit der Anwendung von schwerwiegenden Hautausschlägen berichtet, die einen Krankenhausaufenthalt und einen Abbruch der Behandlung erfordern Armodafinil und bei Erwachsenen und Kindern in Verbindung mit der Verwendung von Modafinil, einer racemischen Mischung von S- und R-Modafinil (letzteres ist Armodafinil).
Armodafinil wurde in keiner Umgebung bei pädiatrischen Patienten untersucht und ist für die Anwendung bei pädiatrischen Patienten für keine Indikation zugelassen.
In klinischen Studien mit Erwachsenen (0 pro 1.595) mit Armodafinil wurden keine schwerwiegenden Hautausschläge berichtet. Es wurden jedoch Fälle von schwerem Hautausschlag bei Erwachsenen nach dem Inverkehrbringen gemeldet. Da Armodafinil das R-Isomer von racemischem Modafinil ist, kann ein ähnliches Risiko eines schweren Hautausschlags bei pädiatrischen Patienten mit Armodafinil nicht ausgeschlossen werden.
In klinischen Studien mit Modafinil (dem Racemat) betrug die Häufigkeit von Hautausschlägen, die zum Absetzen führten, bei pädiatrischen Patienten (Alter <17 Jahre) etwa 0,8% (13 pro 1.585); Diese Hautausschläge umfassten 1 Fall eines möglichen Stevens-Johnson-Syndroms (SJS) und 1 Fall einer offensichtlichen Überempfindlichkeitsreaktion gegen mehrere Organe. Einige der Fälle waren mit Fieber und anderen Anomalien verbunden (z. B. Erbrechen, Leukopenie). Die mediane Zeit bis zum Hautausschlag, die zum Absetzen führte, betrug 13 Tage. Bei 380 pädiatrischen Patienten, die ein Placebo erhielten, wurden keine derartigen Fälle beobachtet. In klinischen Studien mit Erwachsenen (0 pro 4.264) mit Modafinil wurden keine schwerwiegenden Hautausschläge berichtet. Seltene Fälle von schwerem oder lebensbedrohlichem Hautausschlag, einschließlich SJS, Toxic Epidermal Necrolysis (TEN) und Drug Rash with Eosinophilie und systemische Symptome (DRESS) wurden bei Erwachsenen und Kindern nach weltweiter Erfahrung nach dem Inverkehrbringen berichtet mit Modafinil. Die Meldungsrate von TEN und SJS im Zusammenhang mit der Verwendung von Modafinil, die aufgrund von Unterberichterstattung allgemein als unterschätzt angesehen wird, übersteigt die Hintergrundinzidenzrate. Schätzungen der Hintergrundinzidenzrate für diese schwerwiegenden Hautreaktionen in der Allgemeinbevölkerung liegen zwischen 1 und 2 Fällen pro Million Personenjahre.
Es sind keine Faktoren bekannt, die das Risiko des Auftretens oder die Schwere des mit Armodafinil oder Modafinil verbundenen Hautausschlags vorhersagen. Fast alle Fälle von schwerem Hautausschlag im Zusammenhang mit Armodafinil oder Modafinil traten innerhalb von 1 bis 5 Wochen nach Beginn der Behandlung auf. Es wurden jedoch Einzelfälle nach längerer Behandlung mit Modafinil (z. B. 3 Monate) berichtet. Dementsprechend kann die Therapiedauer nicht als Mittel zur Vorhersage des potenziellen Risikos herangezogen werden, das durch das erste Auftreten eines Hautausschlags ausgelöst wird.
Obwohl bei Armodafinil auch gutartige Hautausschläge auftreten, ist es nicht möglich, zuverlässig vorherzusagen, welche Hautausschläge sich als schwerwiegend erweisen werden. Dementsprechend sollte Armodafinil normalerweise beim ersten Anzeichen eines Hautausschlags abgesetzt werden, es sei denn, der Hautausschlag ist eindeutig nicht drogenbedingt. Ein Absetzen der Behandlung kann nicht verhindern, dass ein Ausschlag lebensbedrohlich wird oder dauerhaft deaktiviert oder entstellt.
Angioödeme und anaphylaktoide Reaktionen
Ein schwerwiegender Fall von Angioödem und ein Fall von Überempfindlichkeit (mit Hautausschlag, Dysphagie und Bronchospasmus) wurden bei 1.595 mit Armodafinil behandelten Patienten beobachtet. Patienten sollten angewiesen werden, die Therapie abzubrechen und Anzeichen sofort ihrem Arzt zu melden oder Symptome, die auf ein Angioödem oder eine Anaphylaxie hinweisen (z. B. Schwellung von Gesicht, Augen, Lippen, Zunge oder Larynx; Schwierigkeiten beim Schlucken oder Atmen; Heiserkeit).
Multi-Organ-Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen bei mehreren Organen, einschließlich mindestens eines Todesfalls nach Markteinführung trat in enger zeitlicher Assoziation (mediane Zeit bis zur Entdeckung 13 Tage: Bereich 4-33) zum Beginn der Modafinil. Ein ähnliches Risiko für Überempfindlichkeitsreaktionen mehrerer Organe mit Armodafinil kann nicht ausgeschlossen werden.
Obwohl nur eine begrenzte Anzahl von Berichten vorliegt, können Überempfindlichkeitsreaktionen bei mehreren Organen zu Krankenhausaufenthalten oder lebensbedrohlichen Ereignissen führen. Es sind keine Faktoren bekannt, die das Risiko eines Auftretens oder die Schwere von mit Modafinil verbundenen Überempfindlichkeitsreaktionen bei mehreren Organen vorhersagen. Anzeichen und Symptome dieser Störung waren vielfältig; Bei Patienten treten jedoch typischerweise, wenn auch nicht ausschließlich, Fieber und Hautausschläge auf, die mit einer Beteiligung anderer Organsysteme verbunden sind. Andere Begleiterscheinungen waren Myokarditis, Hepatitis, Leberfunktionsstörungen, hämatologische Anomalien (z. B. Eosinophilie, Leukopenie, Thrombozytopenie), Juckreiz und Asthenie. Da die Überempfindlichkeit gegen mehrere Organe in ihrer Expression unterschiedlich ist, können andere, hier nicht erwähnte Symptome und Anzeichen des Organsystems auftreten.
Bei Verdacht auf eine Überempfindlichkeitsreaktion mit mehreren Organen sollte NUVIGIL abgesetzt werden. Obwohl es keine Fallberichte gibt, die auf eine Kreuzempfindlichkeit mit anderen Arzneimitteln hinweisen, die dieses Syndrom hervorrufen, Die Erfahrung mit Medikamenten, die mit einer Überempfindlichkeit gegen mehrere Organe in Verbindung gebracht werden, würde darauf hinweisen, dass dies eine Möglichkeit.
Anhaltende Schläfrigkeit
Patienten mit anormaler Schläfrigkeit, die NUVIGIL einnehmen, sollten darauf hingewiesen werden, dass sich ihr Wachzustand möglicherweise nicht normalisiert. Patienten mit übermäßiger Schläfrigkeit, einschließlich derjenigen, die NUVIGIL einnehmen, sollten häufig auf ihre Symptome überprüft werden Grad der Schläfrigkeit und gegebenenfalls empfohlen, das Fahren zu vermeiden oder andere potenzielle Gefahren zu vermeiden Aktivität. Verschreiber sollten sich auch bewusst sein, dass Patienten möglicherweise Schläfrigkeit oder Benommenheit erst dann anerkennen, wenn sie bei bestimmten Aktivitäten direkt nach Schläfrigkeit oder Benommenheit gefragt werden.
Psychiatrische Symptome
Bei Patienten, die mit Modafinil behandelt wurden, wurden psychiatrische Nebenwirkungen berichtet. Modafinil und Armodafinil (NUVIGIL) sind sehr eng miteinander verwandt. Daher ist zu erwarten, dass Inzidenz und Art der mit Armodafinil verbundenen psychiatrischen Symptome der Inzidenz und Art dieser Ereignisse mit Modafinil ähnlich sind.
Nebenwirkungen nach dem Inverkehrbringen im Zusammenhang mit der Anwendung von Modafinil waren Manie, Wahnvorstellungen, Halluzinationen, Suizidgedanken und Aggressionen, die teilweise zu Krankenhausaufenthalten führten. Viele, aber nicht alle Patienten hatten eine psychiatrische Vorgeschichte. Ein gesunder männlicher Proband entwickelte Vorstellungen von Referenz, paranoiden Wahnvorstellungen und Gehörhalluzinationen in Verbindung mit mehreren täglichen Dosen von 600 mg Modafinil und Schlafentzug. Es gab keine Hinweise auf eine Psychose 36 Stunden nach Absetzen des Arzneimittels.
In der NUVIGIL-Datenbank der kontrollierten Studie waren Angstzustände, Erregung, Nervosität und Reizbarkeit die Gründe für Behandlungsabbruch häufiger bei Patienten unter NUVIGIL im Vergleich zu Placebo (NUVIGIL 1,2% und Placebo) 0.3%). In den NUVIGIL-kontrollierten Studien war eine Depression auch ein Grund für den häufiger auftretenden Therapieabbruch bei Patienten unter NUVIGIL im Vergleich zu Placebo (NUVIGIL 0,6% und Placebo 0,2%). In klinischen Studien wurden zwei Fälle von Suizidgedanken beobachtet. Vorsicht ist geboten, wenn NUVIGIL bei Patienten angewendet wird, bei denen in der Vorgeschichte Psychosen, Depressionen oder Manien aufgetreten sind. Wenn sich im Zusammenhang mit der Anwendung von NUVIGIL psychiatrische Symptome entwickeln, sollten Sie erwägen, NUVIGIL abzusetzen.
oben
VORSICHTSMASSNAHMEN
Diagnose von Schlafstörungen
NUVIGIL darf nur bei Patienten angewendet werden, bei denen eine vollständige Beurteilung der übermäßigen Schläfrigkeit durchgeführt wurde und bei denen a Die Diagnose von Narkolepsie, OSAHS und / oder SWSD wurde gemäß den Kriterien der ICSD - oder DSM - Diagnose gestellt (vgl Klinische Versuche). Eine solche Bewertung besteht in der Regel aus einer vollständigen Anamnese und körperlichen Untersuchung und kann durch Tests in einem Labor ergänzt werden. Einige Patienten können mehr als eine Schlafstörung aufweisen, die zu ihrer übermäßigen Schläfrigkeit beiträgt (z. B. OSAHS und SWSD, die bei demselben Patienten zusammenfallen).
CPAP-Anwendung bei Patienten mit OSAHS
In OSAHS ist NUVIGIL als Ergänzung zu Standardbehandlungen für die zugrunde liegende Obstruktion angezeigt. Wenn für einen Patienten ein kontinuierlicher positiver Atemwegsdruck (CPAP) die Behandlung der Wahl ist, sollten vor Beginn der Behandlung mit NUVIGIL maximale Anstrengungen unternommen werden, um einen angemessenen Zeitraum mit CPAP zu behandeln. Wenn NUVIGIL zusammen mit CPAP angewendet wird, ist die Förderung und regelmäßige Bewertung der CPAP-Konformität erforderlich. Im Laufe der Zeit war ein leichter Trend zu einer verringerten CPAP-Anwendung zu verzeichnen (durchschnittliche Verkürzung um 18 Minuten bei Patienten, die mit NUVIGIL behandelt wurden) und eine 6-minütige Reduktion für mit Placebo behandelte Patienten ab einer durchschnittlichen Baseline-Einnahme von 6,9 Stunden pro Nacht in NUVIGIL Versuche.
Allgemeines
Obwohl bei NUVIGIL keine funktionelle Beeinträchtigung nachgewiesen wurde, kann jedes Medikament, das das ZNS beeinflusst, das Urteilsvermögen, das Denken oder die motorischen Fähigkeiten verändern. Patienten sollten vor dem Bedienen eines Autos oder anderer gefährlicher Maschinen gewarnt werden, bis sie es sind mit ziemlicher Sicherheit, dass die NUVIGIL-Therapie ihre Fähigkeit zur Teilnahme an einer solchen Therapie nicht beeinträchtigt Aktivitäten.
Herz-Kreislauf-System
NUVIGIL wurde bei Patienten mit Myokardinfarkt oder instabiler Angina in der jüngsten Vergangenheit nicht in nennenswertem Umfang untersucht oder angewendet, und solche Patienten sollten mit Vorsicht behandelt werden.
In klinischen Studien zu PROVIGIL wurden Anzeichen und Symptome einschließlich Brustschmerzen, Herzklopfen, Atemnot und vorübergehender Ischämie festgestellt T-Wellen-Veränderungen im EKG wurden bei drei Probanden in Verbindung mit Mitralklappenprolaps oder linksventrikulär beobachtet Hypertrophie. Es wird empfohlen, NUVIGIL-Tabletten nicht bei Patienten mit linksventrikulärer Hypertrophie in der Vorgeschichte oder in der Vorgeschichte anzuwenden Patienten mit Mitralklappenprolaps, die das Mitralklappenprolaps-Syndrom hatten, als sie zuvor ZNS erhalten hatten Stimulanzien. Anzeichen eines Mitralklappenprolaps-Syndroms sind unter anderem ischämische EKG-Veränderungen, Brustschmerzen oder Arrhythmien. Wenn eines dieser Symptome erneut auftritt, ziehen Sie eine Herzuntersuchung in Betracht.
Die Blutdrucküberwachung in kontrollierten Kurzzeitstudien (3 Monate) zeigte nur geringe durchschnittliche Anstiege des mittleren systolischen und diastolischer Blutdruck bei Patienten, die NUVIGIL im Vergleich zu Placebo erhielten (1,2 bis 4,3 mmHg in den verschiedenen Versuchsreihen) Gruppen). Es gab auch einen etwas größeren Anteil von Patienten unter NUVIGIL, die eine neue oder verstärkte Einnahme von blutdrucksenkenden Medikamenten benötigten (2,9%) als Patienten unter Placebo (1,8%). Eine verstärkte Überwachung des Blutdrucks kann bei Patienten unter NUVIGIL angezeigt sein.
Patienten mit steroidalen Kontrazeptiva
Die Wirksamkeit von steroidalen Kontrazeptiva kann bei Anwendung von NUVIGIL und für einen Monat nach Absetzen der Therapie vermindert sein (vgl Vorsichtsmaßnahmen, Wechselwirkungen mit anderen Medikamenten). Bei Patienten, die mit NUVIGIL behandelt werden, und für einen Monat nach Absetzen der Behandlung mit NUVIGIL werden alternative oder begleitende Verhütungsmethoden empfohlen.
Patienten mit Cyclosporin
Die Blutspiegel von Cyclosporin können bei Anwendung von NUVIGIL gesenkt werden (siehe Vorsichtsmaßnahmen, Wechselwirkungen mit anderen Medikamenten). Die Überwachung der zirkulierenden Cyclosporinkonzentrationen und eine angemessene Dosisanpassung für Cyclosporin sollten in Betracht gezogen werden, wenn diese Arzneimittel gleichzeitig angewendet werden.
Patienten mit schwerer Leberinsuffizienz
Bei Patienten mit schwerer Leberfunktionsstörung mit oder ohne Zirrhose (vgl Klinische Pharmakologie) Sollte NUVIGIL in einer reduzierten Dosis verabreicht werden (siehe Dosierung und Anwendung).
Patienten mit schwerer Niereninsuffizienz
Es liegen unzureichende Informationen vor, um die Sicherheit und Wirksamkeit der Dosierung bei Patienten mit schwerer Nierenfunktionsstörung zu bestimmen (Pharmakokinetik bei Nierenfunktionsstörungen siehe Klinische Pharmakologie).
Ältere Patienten
Bei älteren Patienten kann die Elimination von Armodafinil und seinen Metaboliten infolge des Alterns verringert sein. Daher sollte die Verwendung niedrigerer Dosen in dieser Population in Betracht gezogen werden (vgl Klinische Pharmakologie und Dosierung und Anwendung).
Informationen für Patienten
Ärzten wird geraten, die folgenden Fragen mit Patienten zu besprechen, für die sie NUVIGIL verschreiben.
NUVIGIL ist angezeigt für Patienten mit anormaler Schläfrigkeit. Es wurde gezeigt, dass NUVIGIL diese abnormale Tendenz zum Einschlafen verbessert, aber nicht beseitigt. Daher sollten Patienten ihr vorheriges Verhalten in Bezug auf potenziell gefährliche Aktivitäten (z. B. Fahren, Bedienen von Maschinen) oder Ähnliches nicht ändern Aktivitäten, bei denen ein angemessenes Maß an Wachsamkeit erforderlich ist, bis und sofern nachgewiesen wurde, dass die Behandlung mit NUVIGIL ein solches Maß an Wachsamkeit hervorruft Aktivitäten. Patienten sollten darauf hingewiesen werden, dass NUVIGIL kein Ersatz für Schlaf ist.
Patienten sollten darüber informiert werden, dass es kritisch sein kann, dass sie ihre zuvor verordneten Behandlungen fortsetzen (z. B. sollten Patienten mit OSAHS, die CPAP erhalten, dies auch weiterhin tun).
Die Patienten sollten über die Verfügbarkeit einer Packungsbeilage informiert und angewiesen werden, die Packungsbeilage vor der Einnahme von NUVIGIL zu lesen. In den Patienteninformationen am Ende dieser Kennzeichnung finden Sie den Text der Packungsbeilage für Patienten.
Patienten sollten angewiesen werden, sich bei Hautausschlag, Depressionen, Angstzuständen oder Anzeichen von Psychose oder Manie an ihren Arzt zu wenden.
Schwangerschaft
Patienten sollten angewiesen werden, ihren Arzt zu benachrichtigen, wenn sie schwanger werden oder beabsichtigen, während der Therapie schwanger zu werden. Patienten sollten hinsichtlich des potenziell erhöhten Schwangerschaftsrisikos bei der Verwendung von steroidalen Kontrazeptiva (einschließlich Depot oder implantierbar) gewarnt werden Kontrazeptiva) mit NUVIGIL und für einen Monat nach Absetzen der Therapie (siehe Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit und Schwangerschaft).
Pflege
Patienten sollten angewiesen werden, ihren Arzt zu informieren, wenn sie ein Kind stillen.
Begleitmedikation
Patienten sollten angewiesen werden, ihren Arzt zu informieren, wenn sie welche einnehmen oder planen verschreibungspflichtige oder nicht verschreibungspflichtige Medikamente, da zwischen NUVIGIL und Andere Drogen.
Alkohol
Patienten sollten darauf hingewiesen werden, dass die Anwendung von NUVIGIL in Kombination mit Alkohol nicht untersucht wurde. Patienten sollten darauf hingewiesen werden, dass es ratsam ist, Alkohol während der Einnahme von NUVIGIL zu vermeiden.
Allergische Reaktionen
Patienten sollten angewiesen werden, die Einnahme von NUVIGIL abzubrechen und ihren Arzt zu benachrichtigen, wenn sie einen Ausschlag entwickeln. Nesselsucht, Wunden im Mund, Blasen, schälende Haut, Probleme beim Schlucken oder Atmen oder eine damit verbundene Allergie Phänomen.
Wechselwirkungen mit anderen Medikamenten
Mögliche Wechselwirkungen mit Arzneimitteln, die Cytochrom P450-Isoenzyme und andere Leberenzyme hemmen, induzieren oder durch diese metabolisiert werden
Aufgrund der teilweisen Beteiligung von CYP3A-Enzymen an der metabolischen Elimination von Armodafinil kann die gleichzeitige Verabreichung potenter Induktoren von CYP3A4 / 5 erfolgen (z.B. Carbamazepin, Phenobarbital, Rifampin) oder Inhibitoren von CYP3A4 / 5 (z.B. Ketoconazol, Erythromycin) könnten die Plasmaspiegel von verändern Armodafinil.
Das Potenzial von NUVIGIL, den Metabolismus anderer Arzneimittel durch Enzyminduktion oder -hemmung zu verändern
Durch CYP1A2 metabolisierte Arzneimittel: In-vitro-Daten zeigten, dass Armodafinil eine schwache induktive Reaktion auf CYP1A2 und möglicherweise CYP3A zeigt Aktivitäten in konzentrationsbezogener Weise und zeigten, dass die CYP2C19-Aktivität reversibel gehemmt wird durch Armodafinil. Die Wirkung auf die CYP1A2 - Aktivität wurde jedoch in einer mit Koffein durchgeführten Interaktionsstudie klinisch nicht beobachtet (vgl Klinische Pharmakologie, Pharmakokinetik, Arzneimittel-Wechselwirkungen).
Durch CYP3A4 / 5 metabolisierte Arzneimittel (z. B. Cyclosporin, Ethinylestradiol, Midazolam und Triazolam): Die chronische Verabreichung von NUVIGIL führte zu einer mäßigen Induktion der CYP3A-Aktivität. Daher die Wirksamkeit von Arzneimitteln, die Substrate für CYP3A-Enzyme sind (z. B. Cyclosporin, Ethinyl) Östradiol, Midazolam und Triazolam) können nach Beginn der gleichzeitigen Behandlung mit reduziert werden NUVIGIL. Bei gleichzeitiger Anwendung von Armodafinil mit Midazolam wurde eine Verringerung der systemischen Exposition von oralem Midazolam um 32% beobachtet. Möglicherweise ist eine Dosisanpassung erforderlich (siehe Klinische Pharmakologie, Pharmakokinetik, Arzneimittel-Wechselwirkungen). Solche Effekte (verringerte Konzentrationen) wurden auch bei gleichzeitiger Verabreichung von Modafinil mit Cyclosporin, Ethinylestradiol und Triazolam beobachtet.
Durch CYP2C19 metabolisierte Arzneimittel (z. B. Omeprazol, Diazepam, Phenytoin und Propranolol): Die Verabreichung von NUVIGIL führte zu einer mäßigen Hemmung der CYP2C19-Aktivität. Daher kann eine Dosisreduktion für einige Arzneimittel erforderlich sein, die Substrate für CYP2C19 sind (z. B. Phenytoin, Diazepam und Propranolol, Omeprazol und Clomipramin), wenn sie gleichzeitig mit NUVIGIL verwendet werden. Bei gleichzeitiger Anwendung von Armodafinil mit Omeprazol wurde ein Anstieg der Exposition um 40% beobachtet. (Sehen Klinische Pharmakologie, Pharmakokinetik, Arzneimittel-Wechselwirkungen).
Wechselwirkungen mit dem ZNS A.aktive Drogen
Spezifische Daten zum Wechselwirkungspotential von Armodafinil mit ZNS-Wirkstoffen liegen nicht vor. Die folgenden verfügbaren Informationen zu Arzneimittel-Wechselwirkungen mit Modafinil sollten jedoch auf Armodafinil anwendbar sein (siehe Beschreibung und Klinische Pharmakologie).
Die gleichzeitige Verabreichung von Modafinil mit Methylphenidat oder Dextroamphetamin führte zu keinen signifikanten Veränderungen der Pharmakokinetisches Profil von Modafinil oder einem der beiden Stimulanzien, obwohl die Absorption von Modafinil um ungefähr eins verzögert war Stunde.
Die gleichzeitige Anwendung von Modafinil oder Clomipramin veränderte das PK-Profil beider Arzneimittel nicht. Bei einem Patienten mit Narkolepsie während der Behandlung mit Modafinil wurde jedoch ein Vorfall von erhöhten Clomipraminspiegeln und seinem aktiven Metaboliten Desmethylclomipramin berichtet.
Daten, die für das Wechselwirkungspotential von Armodafinil oder Modafinil mit Monoaminoxidase (MAO) -Inhibitoren spezifisch sind, liegen nicht vor. Daher ist bei gleichzeitiger Anwendung von MAO-Inhibitoren und NUVIGIL Vorsicht geboten.
Wechselwirkungen mit anderen Arzneimitteln
Spezifische Daten zum Wechselwirkungspotential von Armodafinil für weitere andere Arzneimittel liegen nicht vor. Die folgenden verfügbaren Informationen zu Arzneimittel-Wechselwirkungen mit Modafinil sollten jedoch auf Armodafinil anwendbar sein.
Warfarin - Die gleichzeitige Anwendung von Modafinil mit Warfarin führte zu keinen signifikanten Veränderungen der pharmakokinetischen Profile von R- und S-Warfarin. Da in dieser Studie jedoch nur eine einzige Warfarin-Dosis getestet wurde, kann eine pharmakodynamische Wechselwirkung nicht ausgeschlossen werden. Daher sollte eine häufigere Überwachung der Prothrombinzeiten / INR in Betracht gezogen werden, wenn NUVIGIL zusammen mit Warfarin verabreicht wird.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Kanzerogenitätsstudien wurden nicht allein mit Armodafinil durchgeführt. Es wurden Kanzerogenitätsstudien durchgeführt, bei denen Modafinil in der Nahrung 78 Wochen lang an Mäuse und 104 Wochen lang an Ratten in Dosen von 6, 30 und 60 mg / kg / Tag verabreicht wurde. Die höchste untersuchte Dosis entspricht einem 1,5-fachen (Maus) oder 3-fachen (Ratte) der empfohlenen täglichen Dosis von Modafinil (200 mg) für Erwachsene in mg / m2. In diesen Studien gab es keine Hinweise auf eine Tumorentstehung im Zusammenhang mit der Verabreichung von Modafinil. Da in der Mausstudie jedoch eine unzureichende hohe Dosis verwendet wurde, die nicht für eine maximal tolerierte Dosis repräsentativ war, wurde eine nachfolgende Kanzerogenitätsstudie in der Tg durchgeführt. AC transgene Maus. In der Tg ausgewertete Dosen. AC-Assay wurden 125, 250 und 500 mg / kg / Tag dermal verabreicht. Es gab keine Hinweise auf eine Tumorigenität im Zusammenhang mit der Verabreichung von Modafinil; Dieses dermale Modell kann jedoch das krebserzeugende Potenzial eines oral verabreichten Arzneimittels möglicherweise nicht angemessen bewerten.
Mutagenese
Armodafinil wurde in einem In-vitro-Test auf bakterielle Umkehrmutation und in einem In-vitro-Test auf Chromosomenaberration bei Säugetieren in menschlichen Lymphozyten untersucht. Armodafinil war in diesen Tests sowohl in Abwesenheit als auch in Gegenwart einer metabolischen Aktivierung negativ.
Modafinil zeigte in einer Reihe von In-vitro-Tests (d. H. Test auf bakterielle Umkehrmutation, Maus-Lymphom-tk-Test, Chromosomenaberration) keine Hinweise auf ein mutagenes oder klastogenes Potential Assay in menschlichen Lymphozyten, Zelltransformationstest in BALB / 3T3-Mausembryozellen) Assays in Abwesenheit oder Gegenwart von Stoffwechselaktivierung oder in vivo (Mausknochenmark-Mikronukleus) Assays. Modafinil war auch im außerplanmäßigen DNA-Synthesetest in Rattenhepatozyten negativ.
Beeinträchtigung der Fruchtbarkeit
Eine Studie zur Fertilität und frühen Embryonalentwicklung (bis zur Implantation) wurde nicht allein mit Armodafinil durchgeführt.
Orale Verabreichung von Modafinil (Dosen von bis zu 480 mg / kg / Tag) an männliche und weibliche Ratten vor und während der gesamten Behandlung Die Paarung und das Fortbestehen bei Frauen bis zum siebten Tag der Schwangerschaft führten zu einer Verlängerung der Paarungszeit Dosis; Es wurden keine Auswirkungen auf andere Fertilitäts- oder Reproduktionsparameter beobachtet. Die wirkungslose Dosis von 240 mg / kg / Tag war mit einer Plasma-Modafinil-Exposition (AUC) verbunden, die in etwa der beim Menschen bei der empfohlenen Dosis von 200 mg entsprach.
Schwangerschaft
Schwangerschaftskategorie C.
In Studien an Ratten (Armodafinil, Modafinil) und Kaninchen (Modafinil) wurde bei klinisch relevanten Expositionen eine Entwicklungstoxizität beobachtet.
Die orale Verabreichung von Armodafinil (60, 200 oder 600 mg / kg / Tag) an trächtige Ratten während des gesamten Zeitraums der Organogenese führte zu einem Anstieg Inzidenzen von viszeralen und skelettalen Variationen des Fetus bei der mittleren Dosis oder höher und verringertes Körpergewicht des Fötus am höchsten Dosis. Die wirkungslose Dosis für die embryofetale Entwicklungstoxizität bei Ratten war mit einem Plasma-Armodafinil assoziiert Exposition (AUC) ungefähr das 0,03-fache der AUC beim Menschen bei der empfohlenen Tageshöchstdosis von 250 mg.
Modafinil (50, 100 oder 200 mg / kg / Tag), das trächtigen Ratten während des gesamten Zeitraums der Organogenese oral verabreicht wurde, in Abwesenheit von maternale Toxizität, eine Zunahme der Resorptionen und eine erhöhte Inzidenz von viszeralen und skelettalen Variationen bei den Nachkommen am höchsten Dosis. Die höhere No-Effect-Dosis für die embryofetale Entwicklungstoxizität bei Ratten war mit einem Plasma assoziiert Modafinil-Exposition ungefähr das 0,5-fache der AUC beim Menschen bei der empfohlenen Tagesdosis (RHD) von 200 mg. In einer anschließenden Studie mit bis zu 480 mg / kg / Tag (Plasma-Modafinil-Exposition etwa 2-fache AUC beim Menschen bei RHD) wurden jedoch keine nachteiligen Auswirkungen auf die Embryofetalentwicklung beobachtet.
Modafinil wird trächtigen Kaninchen während des gesamten Zeitraums der Organogenese in Dosen von bis zu 100 oral verabreicht mg / kg / Tag (Plasma-Modafinil-AUC entspricht in etwa der AUC beim Menschen bei RHD) hatte keine Auswirkung auf den Embryofetalismus Entwicklung; Die verwendeten Dosen waren jedoch zu niedrig, um die Auswirkungen von Modafinil auf die Embryofetalentwicklung angemessen beurteilen zu können. In einer anschließenden Studie zur Entwicklungstoxizität wurden Dosen von 45, 90 und 180 mg / kg / Tag bei Schwangeren bewertet Bei Kaninchen waren die Häufigkeit fetaler Strukturveränderungen und der embryofetale Tod am höchsten Dosis. Die höchste No-Effect-Dosis für die Entwicklungstoxizität war mit einer Plasma-Modafinil-AUC assoziiert, die ungefähr der AUC beim Menschen bei RHD entsprach.
Die Verabreichung von Modafinil an Ratten während der Schwangerschaft und Stillzeit in oralen Dosen von bis zu 200 mg / kg / Tag führte zu einer Verringerung Lebensfähigkeit der Nachkommen bei Dosen von mehr als 20 mg / kg / Tag (Plasma - Modafinil - AUC ungefähr das 0,1 - fache der AUC beim Menschen am RHD). Bei überlebenden Nachkommen wurden keine Auswirkungen auf die postnatalen Entwicklungs- und Neuroverhaltensparameter beobachtet.
Es gibt keine adäquaten und kontrollierten Studien zu Armodafinil oder Modafinil bei schwangeren Frauen. In Verbindung mit Armodafinil und Modafinil wurden zwei Fälle von intrauteriner Wachstumsverzögerung und ein Fall von spontanem Abbruch berichtet. Obwohl die Pharmakologie von Armodafinil nicht mit der von sympathomimetischen Aminen identisch ist, weist es in dieser Klasse einige pharmakologische Eigenschaften auf. Bestimmte dieser Medikamente wurden mit intrauteriner Wachstumsverzögerung und spontanen Aborten in Verbindung gebracht. Ob es sich bei den mit Armodafinil gemeldeten Fällen um Arzneimittel handelt, ist nicht bekannt.
Armodafinil oder Modafinil sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Arbeit und Lieferung
Die Wirkung von Armodafinil auf Wehen und Geburt beim Menschen wurde nicht systematisch untersucht.
Stillende Mutter
Es ist nicht bekannt, ob Armodafinil oder seine Metaboliten in die Muttermilch übergehen. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn einer stillenden Frau NUVIGIL-Tabletten verabreicht werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit der Anwendung von Armodafinil bei Personen unter 17 Jahren wurde nicht untersucht. Bei pädiatrischen Patienten, die Modafinil erhielten, wurde ein schwerwiegender Ausschlag beobachtet
Geiratric Verwendung
Sicherheit und Wirksamkeit bei Personen über 65 Jahren wurden nicht nachgewiesen.
oben
Nebenwirkungen
Armodafinil wurde zur Sicherheit bei über 1100 Patienten mit übermäßiger Schläfrigkeit im Zusammenhang mit primären Schlaf- und Wachzuständen untersucht. In klinischen Studien wurde festgestellt, dass NUVIGIL im Allgemeinen gut verträglich ist und die meisten Nebenwirkungen leicht bis mittelschwer waren.
In den placebokontrollierten klinischen Studien wurden die häufigsten Nebenwirkungen (5%) im Zusammenhang mit der Anwendung beobachtet Kopfschmerzen, Übelkeit, Schwindel und NUVIGIL traten häufiger auf als bei den mit Placebo behandelten Patienten Schlaflosigkeit. Das Nebenwirkungsprofil war in allen Studien ähnlich.
In den placebokontrollierten klinischen Studien brachen 44 der 645 Patienten (7%), die NUVIGIL erhielten, die Behandlung aufgrund einer unerwünschten Erfahrung ab, verglichen mit 16 der 445 (4%) der Patienten, die Placebo erhielten. Der häufigste Grund für das Absetzen war Kopfschmerz (1%).
Inzidenz in kontrollierten Studien
Die folgende Tabelle (Tabelle 3) zeigt die negativen Erfahrungen, die mit einer Rate von 1% oder mehr aufgetreten sind und mehr waren häufig bei Patienten, die mit NUVIGIL behandelt wurden, als bei Patienten der Placebo-Gruppe in den placebokontrollierten klinischen Studien.
Der verschreibende Arzt sollte sich darüber im Klaren sein, dass die unten angegebenen Zahlen nicht zur Vorhersage der Häufigkeit von Nebenwirkungen in der EU verwendet werden können Verlauf der üblichen medizinischen Praxis, bei der sich die Patienteneigenschaften und andere Faktoren von denen unterscheiden können, die während der klinischen Behandlung auftreten Studien. In ähnlicher Weise können die angegebenen Häufigkeiten nicht direkt mit Zahlen verglichen werden, die aus anderen klinischen Untersuchungen mit unterschiedlichen Behandlungen, Verwendungen oder Forschern stammen. Die Überprüfung dieser Häufigkeiten bietet den Verschreibern jedoch eine Grundlage für die Abschätzung des relativen Beitrags von Drogen- und Nicht-Drogen-Faktoren zum Auftreten von unerwünschten Ereignissen in der untersuchten Population.
| System Orgelklasse MedDRA bevorzugter Begriff |
Nuvigil (Prozent, N = 645) |
Placebo (Prozent, N = 445) |
ª Vier doppelblinde, placebokontrollierte klinische Studien zu SWSD, OSAHS und Narkolepsie; Inzidenz wird auf das nächste ganze Prozent gerundet. Eingeschlossen sind nur Ereignisse, bei denen die Inzidenz von Nuvigil höher ist als die von Placebo. | ||
| Herzerkrankungen | ||
| Herzklopfen | 2 | 1 |
| Gastrointestinale Störungen | ||
| Übelkeit | 7 | 3 |
| Durchfall | 4 | 2 |
| Trockener Mund | 4 | 1 |
| Dyspepsie | 2 | 0 |
| Bauchschmerzen Upper | 2 | 1 |
| Verstopfung | 1 | 0 |
| Erbrechen | 1 | 0 |
| Lose Stühle | 1 | 0 |
| Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | ||
| Ermüden | 2 | 1 |
| Durst | 1 | 0 |
| Influenza-ähnliche Krankheit | 1 | 0 |
| Schmerzen | 1 | 0 |
| Pyrexie | 1 | 0 |
| Störungen des Immunsystems | ||
| Saisonale Allergie | 1 | 0 |
| Untersuchungen | ||
| Gamma-Glutamyltransferase erhöht | 1 | 0 |
| Herzfrequenz erhöht | 1 | 0 |
| Stoffwechsel- und Ernährungsstörungen | ||
| Anorexie | 1 | 0 |
| Verminderter Appetit | 1 | 0 |
| Störungen des Nervensystems | ||
| Kopfschmerzen | 17 | 9 |
| Schwindel | 5 | 2 |
| Störung in der Aufmerksamkeit | 1 | 0 |
| Tremor | 1 | 0 |
| Migräne | 1 | 0 |
| Parästhie | 1 | 0 |
| Psychische Störungen | ||
| Schlaflosigkeit | 5 | 1 |
| Angst | 4 | 1 |
| Depression | 2 | 0 |
| Agitation | 1 | 0 |
| Nervosität | 1 | 0 |
| Depressive Stimmung | 1 | 0 |
| Erkrankungen der Nieren und Harnwege | ||
| Polyurie | 1 | 0 |
| Erkrankungen der Atemwege, des Brustraums und des Mediastinums | ||
| Dyspnoe | 1 | 0 |
| Haut- und Unterhauterkrankungen | ||
| Ausschlag | 2 | 0 |
| Kontaktdermatitis | 1 | 0 |
| Hyperhydrose | 1 | 0 |
Dosisabhängigkeit unerwünschter Ereignisse
In den placebokontrollierten klinischen Studien, in denen Dosen von 150 mg / Tag und 250 mg / Tag Nuvigil und Placebo verglichen wurden, Die einzigen Nebenwirkungen, die dosisabhängig zu sein schienen, waren Kopfschmerzen, Hautausschlag, Depressionen, Mundtrockenheit, Schlaflosigkeit und Übelkeit.
ª Vier doppelblinde, placebokontrollierte klinische Studien bei SWSD, OSAHS und Narkolepsie. | ||||
| System Orgelklasse MedDRA bevorzugter Begriff |
Nuvigil 250 mg (Prozent, N = 198) |
Nuvigil 150 mg (Prozent, N = 447) |
Nuvigil Kombiniert (Prozent, N = 645) |
Placebo (Prozent, N = 445) |
|---|---|---|---|---|
| Gastrointestinale Störungen | ||||
| Übelkeit | 9 | 6 | 7 | 3 |
| Trockener Mund | 7 | 2 | 4 | <1 |
| Störungen des Nervensystems | ||||
| Kopfschmerzen | 23 | 14 | 17 | 9 |
| Psychische Störungen | ||||
| Schlaflosigkeit | 6 | 4 | 5 | 1 |
| Depression | 3 | 1 | 2 | <1 |
| Haut- und Unterhauterkrankungen | ||||
| Ausschlag | 4 | 1 | 2 | <1 |
Vitalzeichenänderungen
In kontrollierten Studien gab es kleine, aber konsistente Anstiege der Durchschnittswerte für den mittleren systolischen und diastolischen Blutdruck (siehe Vorsichtsmaßnahmen). In kontrollierten Studien gab es einen kleinen, aber konsistenten durchschnittlichen Anstieg der Pulsfrequenz gegenüber Placebo. Dieser Anstieg variierte von 0,9 bis 3,5 BPM.
Labor Änderungen
Die Parameter für klinische Chemie, Hämatologie und Urinanalyse wurden in den Studien überwacht. Die mittleren Plasmaspiegel von Gamma-Glutamyltransferase (GGT) und alkalischer Phosphatase (AP) waren nach Verabreichung von NUVIGIL höher, jedoch nicht von Placebo. Nur wenige Probanden wiesen jedoch GGT- oder AP-Erhöhungen außerhalb des normalen Bereichs auf. Es waren keine Unterschiede bei Alaninaminotransferase, Aspartataminotransferase, Gesamtprotein, Albumin oder Gesamtbilirubin, obwohl es seltene Fälle von isolierten Erhöhungen von AST und / oder ALT gab. Ein einziger Fall von leichter Panzytopenie wurde nach 35-tägiger Behandlung beobachtet und verschwand mit Absetzen des Arzneimittels. In klinischen Studien wurde eine geringfügige Abnahme der Serumharnsäure gegenüber dem Ausgangswert im Vergleich zu Placebo beobachtet. Die klinische Bedeutung dieses Befundes ist unbekannt.
EKG-Änderungen
In placebokontrollierten klinischen Studien konnte kein Muster von EKG-Anomalien auf die Verabreichung von NUVIGIL zurückgeführt werden.
oben
Drogenmissbrauch und Abhängigkeit
Kontrollierte Substanzklasse
Armodafinil (NUVIGIL) ist eine von Schedule IV kontrollierte Substanz.
Missbrauchspotential und Abhängigkeit
Obwohl das Missbrauchspotential von Armodafinil nicht speziell untersucht wurde, ist sein Missbrauchspotential wahrscheinlich ähnlich dem von Modafinil (PROVIGIL). Modafinil verursacht beim Menschen psychoaktive und euphorische Wirkungen, Stimmungs-, Wahrnehmungs-, Denk- und Gefühlsveränderungen, die für andere ZNS-Stimulanzien typisch sind. In In-vitro-Bindungsstudien bindet Modafinil an die Dopamin-Wiederaufnahmestelle und verursacht einen Anstieg des extrazellulären Dopamins, jedoch keinen Anstieg der Dopaminfreisetzung. Modafinil verstärkt sich, wie seine Selbstverabreichung bei Affen zeigt, die zuvor für die Selbstverabreichung von Kokain ausgebildet wurden. In einigen Studien wurde Modafinil auch teilweise als stimulansähnlich diskriminiert. Ärzte sollten Patienten genau verfolgen, insbesondere Patienten mit Drogen- und / oder Stimulanzienmissbrauch (z. B. Methylphenidat, Amphetamin oder Kokain) in der Vorgeschichte. Patienten sollten auf Anzeichen von Missbrauch oder Missbrauch hin beobachtet werden (z. B. inkrementelle Dosierung oder Drogensuchverhalten).
Das Missbrauchspotential von Modafinil (200, 400 und 800 mg) wurde in einer stationären Studie an Personen, die mit Drogenmissbrauch konfrontiert waren, im Vergleich zu Methylphenidat (45 und 90 mg) bewertet. Die Ergebnisse dieser klinischen Studie zeigten, dass Modafinil psychoaktive und euphorische Wirkungen und Gefühle hervorrief, die mit anderen geplanten ZNS-Stimulanzien (Methylphenidat) übereinstimmen.
oben
Überdosis
Menschliche Erfahrung
In den klinischen NUVIGIL-Studien wurden keine Überdosierungen berichtet. Die Symptome einer NUVIGIL-Überdosierung ähneln wahrscheinlich denen von Modafinil. Eine Überdosierung in klinischen Studien mit Modafinil umfasste Erregung oder Erregung, Schlaflosigkeit und leichte oder mäßige Erhöhungen der hämodynamischen Parameter. Nach der Markteinführung von Modafinil wurden keine tödlichen Überdosierungen mit Modafinil allein (Dosen bis zu 12 Gramm) berichtet. Überdosierungen mit mehreren Medikamenten, einschließlich Modafinil, führten zu tödlichen Folgen. Zu den Symptomen, die am häufigsten mit einer Überdosierung von Modafinil allein oder in Kombination mit anderen Arzneimitteln einhergehen, gehören: Schlaflosigkeit; Symptome des Zentralnervensystems wie Unruhe, Orientierungslosigkeit, Verwirrtheit, Erregung und Halluzination; Verdauungsstörungen wie Übelkeit und Durchfall; und kardiovaskuläre Veränderungen wie Tachykardie, Bradykardie, Bluthochdruck und Brustschmerzen.
Überdosis-Management
Es gibt kein spezifisches Gegenmittel für die toxischen Wirkungen einer NUVIGIL-Überdosis. Solche Überdosierungen sollten in erster Linie unterstützend behandelt werden, einschließlich kardiovaskulärer Überwachung. Wenn keine Kontraindikationen vorliegen, sollte ein induziertes Erbrechen oder eine Magenspülung in Betracht gezogen werden. Es gibt keine Daten, die auf die Nützlichkeit der Dialyse oder der Ansäuerung oder Alkalisierung des Harns bei der Verbesserung der Arzneimittelelimination hindeuten. Der Arzt sollte in Betracht ziehen, ein Giftinformationszentrum zu konsultieren, um Ratschläge zur Behandlung einer Überdosis zu erhalten.
oben
Dosierung und Anwendung
Obstruktives Schlafapnoe / Hypopnoe-Syndrom (OSAHS) und Narkolepsie
Die empfohlene Dosis von NUVIGIL für Patienten mit OSAHS oder Narkolepsie beträgt 150 mg oder 250 mg als Einzeldosis am Morgen. Bei Patienten mit OSAHS wurden Dosen von bis zu 250 mg / Tag, die als Einzeldosis verabreicht wurden, gut vertragen Es gibt keinen ständigen Hinweis darauf, dass diese Dosis einen zusätzlichen Nutzen über die Dosis von 150 mg / Tag hinaus bietet (vgl Klinische Pharmakologie und Klinische Versuche).
Schichtarbeit Schlafstörung (SWSD)
Die empfohlene Dosis von NUVIGIL für Patienten mit SWSD beträgt 150 mg täglich ca. 1 Stunde vor Beginn ihrer Arbeitsschicht.
Eine Dosisanpassung sollte für Begleitmedikamente in Betracht gezogen werden, die Substrate für CYP3A4 / 5 sind, wie Steroid-Kontrazeptiva, Triazolam und Cyclosporin (siehe VORSICHTSMASSNAHMEN, Arzneimittelwechselwirkungen).
Medikamente, die weitgehend über den CYP2C19-Metabolismus ausgeschieden werden, wie Diazepam, Propranolol und Phenytoin, können enthalten sein Eine längere Elimination bei gleichzeitiger Anwendung mit NUVIGIL kann eine Dosisreduktion und eine Überwachung auf Toxizität erforderlich machen (Sehen Vorsichtsmaßnahmen, Wechselwirkungen mit anderen Medikamenten).
Bei Patienten mit schwerer Leberfunktionsstörung sollte NUVIGIL in einer reduzierten Dosis verabreicht werden (siehe Klinische Pharmakologie und Vorsichtsmaßnahmen).
Es liegen keine ausreichenden Informationen vor, um die Sicherheit und Wirksamkeit der Dosierung bei Patienten mit schwerer Nierenfunktionsstörung zu bestimmen (vgl Klinische Pharmakologie und Vorsichtsmaßnahmen).
Bei älteren Patienten kann die Elimination von Armodafinil und seinen Metaboliten infolge des Alterns verringert sein. Daher sollte die Verwendung niedrigerer Dosen in dieser Population in Betracht gezogen werden (vgl Klinische Pharmakologie und Vorsichtsmaßnahmen).
oben
Wie geliefert / Lagerung und Handhabung
Nuvigil® (Armodafinil) Tabletten [C-IV]
50 mg: Jede runde, weiße bis cremefarbene Tablette wird mit einer Prägung versehen  auf der einen Seite und "205" auf der anderen Seite.
auf der einen Seite und "205" auf der anderen Seite.
NDC 63459-205-60 - Flaschen mit 60 Stück
150 mg: Jede ovale, weiße bis cremefarbene Tablette ist mit einer Prägung versehen  auf der einen Seite und "215" auf der anderen.
auf der einen Seite und "215" auf der anderen.
NDC 63459-215-60 - Flaschen mit 60 Stück
250 mg: Jede ovale, weiße bis cremefarbene Tablette ist mit einer Prägung versehen  auf der einen Seite und "225" auf der anderen.
auf der einen Seite und "225" auf der anderen.
NDC 63459-225-60 - Flaschen mit 60 Stück
Bei 20 - 25 ° C lagern.
Hergestellt für:
Cephalon, Inc.
Frazer, PA 19355
Letzte Aktualisierung 02/2010
Nuvigil Patienteninformationsblatt (in reinem Englisch)
Detaillierte Informationen zu Anzeichen, Symptome, Ursachen, Behandlungen von Schlafstörungen
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder Ihre Krankenschwester.
zurück zu:
~ Alle Artikel zu Schlafstörungen

