Onglyza zur Behandlung von Diabetes
Markenname: Onglyza
Gattungsname: Saxagliptin
Darreichungsform: Tablette, filmbeschichtet
Inhalt:
Indikationen und Verwendung
Dosierung und Anwendung
Darreichungsformen und Stärken
Kontraindikationen
Warnungen und Vorsichtsmaßnahmen
Nebenwirkungen
Wechselwirkungen mit anderen Medikamenten
Verwendung in bestimmten Populationen
Überdosierung
Beschreibung
Pharmakologie
Nichtklinische Toxikologie
Klinische Studien
Wie geliefert
Onglyza Patienteninformation (in reinem Englisch)
Indikationen und Verwendung
Monotherapie und Kombinationstherapie
Onglyza ist als Ergänzung zu Diät und Bewegung angezeigt, um die Blutzuckerkontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus zu verbessern. [Sehen Klinische Studien].
Wichtige Nutzungsbeschränkungen
Onglyza sollte nicht zur Behandlung von Diabetes mellitus Typ 1 oder diabetischer Ketoazidose angewendet werden, da es in diesen Fällen nicht wirksam wäre.
Onglyza wurde nicht in Kombination mit Insulin untersucht.
oben
Dosierung und Anwendung
Empfohlene Dosierung
Die empfohlene Dosis von Onglyza beträgt 2,5 mg oder 5 mg einmal täglich, unabhängig von den Mahlzeiten.
Patienten mit Nierenfunktionsstörung
Bei Patienten mit leichter Nierenfunktionsstörung (Kreatinin-Clearance [CrCl]> 50 ml / min) wird keine Dosisanpassung für Onglyza empfohlen.
Die Dosis von Onglyza beträgt bei Patienten mit mittelschwerer oder schwerer Nierenfunktionsstörung einmal täglich 2,5 mg mit terminaler Niereninsuffizienz (ESRD), die eine Hämodialyse erfordert (Kreatinin-Clearance [CrCl] Cl 50 ml / min). Onglyza sollte nach Hämodialyse verabreicht werden. Onglyza wurde bei Patienten mit Peritonealdialyse nicht untersucht.
Da die Onglyza-Dosis basierend auf der Nierenfunktion auf 2,5 mg begrenzt sein sollte, wird eine Beurteilung der Nierenfunktion vor Beginn der Onglyza-Behandlung und danach in regelmäßigen Abständen empfohlen. Die Nierenfunktion kann aus Serumkreatinin unter Verwendung der Cockcroft-Gault-Formel oder der Formel zur Ernährungsumstellung bei Nierenerkrankungen geschätzt werden. [Sehen Klinische Pharmakologie, Pharmakokinetik]
Starke CYP3A4 / 5-Inhibitoren
Die Dosis von Onglyza beträgt 2,5 mg einmal täglich, wenn sie zusammen mit starken Cytochrom P450 3A4 / 5 (CYP3A4 / 5) -Inhibitoren (z. Ketoconazol, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Ritonavir, Saquinavir und Telithromycin). [Sehen Wechselwirkungen mit anderen Medikamenten, Inhibitoren von CYP3A4 / 5-Enzymen und Klinische Pharmakologie, Pharmakokinetik]
oben
Darreichungsformen und Stärken
- Onglyza (Saxagliptin) 5 mg Tabletten sind rosa, bikonvexe, runde, filmbeschichtete Tabletten mit "5" auf einer Seite und "4215" auf der Rückseite in blauer Tinte.
- Onglyza (Saxagliptin) 2,5 mg Tabletten sind hellgelbe bis hellgelbe, bikonvexe, runde, filmbeschichtete Tabletten mit "2,5" auf einer Seite und "4214" auf der Rückseite in blauer Tinte.
oben
Kontraindikationen
Keiner.
oben
Warnungen und Vorsichtsmaßnahmen
Verwendung mit Medikamenten, von denen bekannt ist, dass sie Hypoglykämie verursachen
Insulinsekretagogen wie Sulfonylharnstoffe verursachen Hypoglykämie. Daher kann eine niedrigere Dosis des Insulinsekretagogen erforderlich sein, um das Risiko einer Hypoglykämie in Kombination mit Onglyza zu verringern. [Sehen Nebenwirkungen, Erfahrung in klinischen Studien.]
Makrovaskuläre Ergebnisse
Es liegen keine klinischen Studien vor, die schlüssige Hinweise auf eine Verringerung des makrovaskulären Risikos mit Onglyza oder einem anderen Antidiabetikum liefern.
oben
Nebenwirkungen
Erfahrung in klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, wurden in den klinischen Studien von a Das Medikament kann nicht direkt mit den Raten in den klinischen Studien eines anderen Medikaments verglichen werden und spiegelt möglicherweise nicht die Raten wider, die in trainieren.
Monotherapie und Zusatzkombinationstherapie
In zwei placebokontrollierten Monotherapie-Studien mit einer Dauer von 24 Wochen wurden die Patienten mit 2,5 mg Onglyza täglich, 5 mg Onglyza täglich und Placebo behandelt. Außerdem wurden drei 24-wöchige, placebokontrollierte, zusätzliche Kombinationstherapie-Studien durchgeführt: eine mit Metformin, eine mit einem Thiazolidindion (Pioglitazon oder Rosiglitazon) und eine mit Glyburid. In diesen drei Studien wurden die Patienten randomisiert auf eine Zusatztherapie mit 2,5 mg Onglyza täglich, 5 mg Onglyza täglich oder Placebo umgestellt. Ein 10 mg Saxagliptin-Behandlungsarm wurde in eine der Monotherapie-Studien und in die Zusatzkombinationsstudie mit Metformin eingeschlossen.
In einer vorab festgelegten gepoolten Analyse der 24-Wochen-Daten (unabhängig von der glykämischen Rettung) aus den beiden Monotherapie-Studien, dem Add-On zur Metformin-Studie, dem Add-On zur Thiazolidindion (TZD) -Studie, und der Zusatz zur Glyburid-Studie war die Gesamtinzidenz unerwünschter Ereignisse bei Patienten, die mit 2,5 mg Onglyza und 5 mg Onglyza behandelt wurden, ähnlich wie bei Placebo (72,0% und 72,2% gegenüber 70,6%). beziehungsweise). Bei 2,2%, 3,3% und 1,8% der Patienten, die Onglyza 2,5 mg, Onglyza 5 mg bzw. Placebo erhielten, trat ein Therapieabbruch aufgrund unerwünschter Ereignisse auf. Die häufigsten unerwünschten Ereignisse (berichtet bei mindestens 2 mit Onglyza 2,5 mg behandelten Patienten oder mindestens 2 mit Onglyza behandelten Patienten) 5 mg), die mit einem vorzeitigen Absetzen der Therapie einhergingen, umfassten Lymphopenie (0,1% bzw. 0,5% gegenüber 0%), Hautausschlag (0,2% und 0,3% gegenüber 0,3%), Blutkreatinin erhöht (0,3% und 0% gegenüber 0%) und Blutkreatinphosphokinase erhöht (0,1% und 0,2% gegenüber 0%). Die Nebenwirkungen in dieser gepoolten Analyse wurden (unabhängig von der Bewertung der Kausalität durch den Prüfer) in berichtet • 5% der mit Onglyza 5 mg behandelten Patienten und häufiger als bei mit Placebo behandelten Patienten sind in gezeigt Tabelle 1.
Tabelle 1: Nebenwirkungen (unabhängig von der Beurteilung der Kausalität durch den Prüfer) in placebokontrollierten Studien * Berichtet bei 5% der mit Onglyza 5 mg behandelten Patienten und häufiger als bei mit behandelten Patienten Placebo
| Anzahl (%) der Patienten | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * Die 5 placebokontrollierten Studien umfassen zwei Monotherapie-Studien und eine zusätzliche Kombinationstherapie-Studie mit den folgenden Substanzen: Metformin, Thiazolidindion oder Glyburid. Die Tabelle zeigt 24-Wochen-Daten unabhängig von der glykämischen Rettung. | ||
| Infektionen der oberen Atemwege | 68 (7.7) | 61 (7.6) |
| Infektion der Harnwege | 60 (6.8) | 49 (6.1) |
| Kopfschmerzen | 57 (6.5) | 47 (5.9) |
Bei Patienten, die mit 2,5 mg Onglyza behandelt wurden, waren Kopfschmerzen (6,5%) die einzige Nebenwirkung, die mit einer Rate von 5% und häufiger als bei mit Placebo behandelten Patienten berichtet wurde.
In dieser zusammengefassten Analyse wurden Nebenwirkungen bei 2% der mit Onglyza 2,5 mg oder Onglyza 5 mg und 1% häufiger als bei Placebo behandelten Patienten berichtet: Sinusitis (2,9% und 2,6% gegenüber 1,6%), Bauchschmerzen (2,4% und 1,7% gegenüber 0,5%), Gastroenteritis (1,9% und 2,3% gegenüber 0,9%) und Erbrechen (2,2% und 2,3% gegenüber 1,3%) ).
In der Zusatzstudie zur TZD war die Inzidenz peripherer Ödeme bei Onglyza 5 mg höher als bei Placebo (8,1% bzw. 4,3%). Die Inzidenz von peripheren Ödemen für Onglyza 2,5 mg betrug 3,1%. Keine der berichteten Nebenwirkungen eines peripheren Ödems führte zum Absetzen des Studienmedikaments. Die Raten für periphere Ödeme bei Onglyza 2,5 mg und Onglyza 5 mg gegenüber Placebo betrugen 3,6% und 2% gegenüber 3% unter Monotherapie. 2,1% und 2,1% gegenüber 2,2% als Zusatztherapie zu Metformin und 2,4% und 1,2% gegenüber 2,2% als Zusatztherapie zu Metformin Glyburid.
Die Inzidenzrate von Frakturen betrug 1,0 bzw. 0,6 pro 100 Patientenjahre für Onglyza (gepoolte Analyse von 2,5 mg, 5 mg und 10 mg) und Placebo. Die Inzidenzrate von Frakturereignissen bei Patienten, die Onglyza erhielten, stieg im Laufe der Zeit nicht an. Es wurde keine Kausalität festgestellt, und nichtklinische Studien haben keine nachteiligen Auswirkungen von Saxagliptin auf den Knochen gezeigt.
Im klinischen Programm wurde ein Ereignis einer Thrombozytopenie beobachtet, das mit der Diagnose einer idiopathischen thrombozytopenischen Purpura übereinstimmt. Die Beziehung dieses Ereignisses zu Onglyza ist nicht bekannt.
Nebenwirkungen im Zusammenhang mit Onglyza zusammen mit Metformin bei therapienaiven Patienten mit Typ-2-Diabetes
Tabelle 2 zeigt die berichteten Nebenwirkungen (unabhängig von der Beurteilung der Kausalität durch den Prüfer) bei 5% der Patienten Teilnahme an einer zusätzlichen 24-wöchigen, aktiv kontrollierten Studie mit gleichzeitiger Gabe von Onglyza und Metformin bei therapienaiver Therapie Patienten.
Tabelle 2: Ersttherapie mit Kombination von Onglyza und Metformin bei therapienaiven Patienten: Gemeldete Nebenwirkungen (unabhängig von der Beurteilung durch den Prüfer) der Kausalität) bei 5% der mit einer Kombinationstherapie von Onglyza 5 mg plus Metformin behandelten Patienten (und häufiger als bei mit Metformin behandelten Patienten) Allein)
| Anzahl (%) der Patienten | ||
|---|---|---|
| Onglyza 5 mg + Metformin * N = 320 |
Metformin * N = 328 |
|
| * Metformin wurde mit einer Anfangsdosis von 500 mg täglich begonnen und bis zu einem Maximum von 2000 mg täglich titriert. | ||
| Kopfschmerzen | 24 (7.5) | 17 (5.2) |
| Nasopharyngitis | 22 (6.9) | 13 (4.0) |
Hypoglykämie
Nebenwirkungen von Hypoglykämie beruhten auf allen Berichten über Hypoglykämie; Eine gleichzeitige Glukosemessung war nicht erforderlich. In der Add-On-Glyburid-Studie war die Gesamtinzidenz der gemeldeten Hypoglykämie bei Onglyza 2,5 mg und Onglyza 5 mg (13,3% und 14,6%) höher als bei Placebo (10,1%). Die Inzidenz einer bestätigten Hypoglykämie in dieser Studie, definiert als Symptome einer Hypoglykämie, begleitet von einer Der Fingerstick-Glukosewert von 50 mg / dl betrug 2,4% und 0,8% für Onglyza 2,5 mg und Onglyza 5 mg und 0,7% für Placebo. Die Inzidenz der berichteten Hypoglykämie für Onglyza 2,5 mg und Onglyza 5 mg gegenüber Placebo als Monotherapie betrug 4,0% und 5,6% gegenüber Placebo 4,1%, 7,8% bzw. 5,8% gegenüber 5% als Zusatztherapie zu Metformin und 4,1% bzw. 2,7% gegenüber 3,8% als Zusatztherapie zu Metformin TZD. Die Inzidenz der gemeldeten Hypoglykämie betrug 3,4% bei therapienaiven Patienten, denen Onglyza 5 mg plus Metformin verabreicht wurde, und 4,0% bei Patienten, denen Metformin allein verabreicht wurde.
Überempfindlichkeitsreaktionen
Überempfindlichkeits-bedingte Ereignisse wie Urtikaria und Gesichtsödem in der 5-Studien-Pool-Analyse bis Woche 24 wurden bei 1,5%, 1,5% und 0,4% der Patienten berichtet, die Onglyza 2,5 mg, Onglyza 5 mg und Placebo erhielten. beziehungsweise. Keines dieser Ereignisse bei Patienten, die Onglyza erhielten, erforderte einen Krankenhausaufenthalt oder wurde von den Ermittlern als lebensbedrohlich gemeldet. Ein mit Saxagliptin behandelter Patient in dieser zusammengefassten Analyse wurde wegen generalisierter Urtikaria und Gesichtsödem abgebrochen.
Vitalfunktionen
Bei Patienten, die mit Onglyza behandelt wurden, wurden keine klinisch bedeutsamen Veränderungen der Vitalfunktionen beobachtet.
Labortests
Absolute Lymphozytenzahl
Bei Onglyza wurde eine dosisabhängige mittlere Abnahme der absoluten Lymphozytenzahl beobachtet. Ausgehend von einer mittleren absoluten Lymphozytenzahl zu Studienbeginn von ungefähr 2200 Zellen / Mikroliter ergibt sich eine mittlere Abnahme von ungefähr 100 und 120 Zellen / Mikroliter mit Onglyza 5 mg bzw. 10 mg relativ zu Placebo wurden nach 24 Wochen in einer gepoolten Analyse von fünf placebokontrollierten klinischen Studien beobachtet Studien. Ähnliche Effekte wurden beobachtet, wenn Onglyza 5 mg in anfänglicher Kombination mit Metformin im Vergleich zu Metformin allein verabreicht wurde. Bei Onglyza 2,5 mg wurde kein Unterschied zu Placebo beobachtet. Der Anteil der Patienten mit einer Lymphozytenzahl von 750 Zellen / Mikroliter betrug 0,5%, 1,5%, 1,4% und 0,4% in der Saxagliptin-2,5-mg-, 5-mg-, 10-mg- und der Placebo-Gruppe. Bei den meisten Patienten wurde bei wiederholter Onglyza-Exposition kein Rezidiv beobachtet, obwohl bei einigen Patienten nach erneuter Belastung ein rezidivierender Rückgang auftrat, der zum Absetzen von Onglyza führte. Die Abnahme der Lymphozytenzahl war nicht mit klinisch relevanten Nebenwirkungen verbunden.
Die klinische Bedeutung dieser Abnahme der Lymphozytenzahl im Vergleich zu Placebo ist nicht bekannt. Bei klinischer Indikation, z. B. bei ungewöhnlichen oder anhaltenden Infektionen, sollte die Lymphozytenzahl gemessen werden. Die Wirkung von Onglyza auf die Lymphozytenzahl bei Patienten mit Lymphozytenanomalien (z. B. humanes Immundefizienzvirus) ist unbekannt.
Thrombozyten
Onglyza zeigte in den sechs doppelblinden, kontrollierten klinischen Sicherheits- und Wirksamkeitsstudien keinen klinisch bedeutsamen oder konsistenten Effekt auf die Thrombozytenzahl.
oben
Wechselwirkungen mit anderen Medikamenten
Induktoren von CYP3A4 / 5-Enzymen
Rifampin verringerte die Saxagliptin-Exposition signifikant, ohne dass sich die Fläche unter der Zeit-Konzentrations-Kurve (AUC) seines aktiven Metaboliten 5-Hydroxysaxagliptin veränderte. Die Hemmung der Plasmadipeptidylpeptidase-4 (DPP4) -Aktivität über einen Zeitraum von 24 Stunden wurde durch Rifampin nicht beeinflusst. Daher wird eine Dosisanpassung von Onglyza nicht empfohlen. [Sehen Klinische Pharmakologie, Pharmakokinetik]
Inhibitoren von CYP3A4 / 5-Enzymen
Moderate Inhibitoren von CYP3A4 / 5
Diltiazem erhöhte die Exposition von Saxagliptin. Ähnliche Anstiege der Plasmakonzentrationen von Saxagliptin sind in Gegenwart anderer moderater CYP3A4 / 5 zu erwarten Inhibitoren (z. B. Amprenavir, Aprepitant, Erythromycin, Fluconazol, Fosamprenavir, Grapefruitsaft und Verapamil); Eine Dosisanpassung von Onglyza wird jedoch nicht empfohlen. [Sehen Klinische Pharmakologie, Pharmakokinetik]
Starke Inhibitoren von CYP3A4 / 5
Ketoconazol erhöhte die Saxagliptin-Exposition signifikant. Ähnliche signifikante Anstiege der Plasmakonzentrationen von Saxagliptin werden mit anderen starken CYP3A4 / 5-Inhibitoren erwartet (z.B. Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Ritonavir, Saquinavir und Telithromycin). Die Onglyza-Dosis sollte bei gleichzeitiger Anwendung mit einem starken CYP3A4 / 5-Hemmer auf 2,5 mg begrenzt werden. [Sehen Dosierung und Anwendung, Starke CYP3A4 / 5-Inhibitoren und Klinische Pharmakologie, Pharmakokinetik]
oben
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaftskategorie B
Es gibt keine ausreichenden und gut kontrollierten Studien bei schwangeren Frauen. Da Reproduktionsstudien bei Tieren nicht immer ein Hinweis auf das Ansprechen des Menschen sind, sollte Onglyza wie andere Antidiabetika nur dann während der Schwangerschaft angewendet werden, wenn dies eindeutig erforderlich ist.
Saxagliptin war bei keiner getesteten Dosis teratogen, wenn es trächtigen Ratten und Kaninchen während der Organogenese verabreicht wurde. Eine unvollständige Ossifikation des Beckens, eine Form der Entwicklungsverzögerung, trat bei Ratten bei einer Dosis von 240 mg / kg oder ungefähr 1503 auf und 66-fache Exposition des Menschen gegenüber Saxagliptin bzw. dem aktiven Metaboliten bei der empfohlenen Höchstdosis beim Menschen (MRHD) von 5 mg. Die maternale Toxizität und das verringerte Körpergewicht des Fötus wurden beim 7986-fachen und beim 328-fachen der Exposition des Menschen bei der MRHD für Saxagliptin bzw. den aktiven Metaboliten beobachtet. Bei Kaninchen traten geringfügige Skelettveränderungen bei einer maternaltoxischen Dosis von 200 mg / kg oder etwa dem 1432- und 992-fachen der MRHD auf. Bei Verabreichung an Ratten in Kombination mit Metformin war Saxagliptin bei 21-facher Exposition gegenüber Saxagliptin MRHD weder teratogen noch embryoletisch. Die kombinierte Gabe von Metformin mit einer höheren Saxagliptin-Dosis (109-fache Saxagliptin-MRHD) war verbunden mit craniorachischisis (ein seltener Neuralrohrdefekt, der durch einen unvollständigen Verschluss von Schädel und Wirbelsäule gekennzeichnet ist) bei zwei Feten aus a einzelne Mutter. Die Metformin-Expositionen in jeder Kombination waren viermal so hoch wie die Exposition des Menschen von 2000 mg täglich.
Saxagliptin, das weiblichen Ratten vom 6. bis zum 20. Laktationstag verabreicht wurde, führte zu einer Verringerung des Körpergewichts bei männlichen und männlichen Ratten weibliche Nachkommen nur in maternaltoxischen Dosen (Exposition 1629 ¥ und 53fache Saxagliptin und sein aktiver Metabolit bei der MRHD). Bei Nachkommen von Ratten, denen Saxagliptin in irgendeiner Dosis verabreicht wurde, wurde keine funktionelle oder Verhaltenstoxizität beobachtet.
Saxagliptin durchdringt die Plazenta des Fötus nach der Gabe bei trächtigen Ratten.
Stillende Mutter
Saxagliptin wird in der Milch von laktierenden Ratten in einem Verhältnis von ungefähr 1: 1 mit Plasma-Wirkstoffkonzentrationen ausgeschieden. Es ist nicht bekannt, ob Saxagliptin in die Muttermilch übergeht. Da viele Medikamente in die Muttermilch abgegeben werden, ist Vorsicht geboten, wenn Onglyza einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von Onglyza bei pädiatrischen Patienten wurden nicht untersucht.
Geriatrische Anwendung
In den sechs doppelblinden, kontrollierten klinischen Studien zur Sicherheit und Wirksamkeit von Onglyza waren 634 (15,3%) der 4148 randomisierten Patienten 65 Jahre und älter, und 59 (1,4%) Patienten waren 75 Jahre und älter. Insgesamt wurden keine Unterschiede in Bezug auf Sicherheit oder Wirksamkeit zwischen Patienten im Alter von 65 Jahren und den jüngeren Patienten beobachtet. Während diese klinische Erfahrung keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt hat, kann eine größere Empfindlichkeit einiger älterer Personen nicht ausgeschlossen werden.
Saxagliptin und sein aktiver Metabolit werden zum Teil von der Niere ausgeschieden. Da ältere Patienten mit höherer Wahrscheinlichkeit eine verminderte Nierenfunktion haben, sollte bei älteren Patienten die Dosis anhand der Nierenfunktion sorgfältig ausgewählt werden. [Sehen Dosierung und AnwendungPatienten mit Niereninsuffizienz und Klinische Pharmakologie, Pharmakokinetik]
oben
Überdosierung
In einer kontrollierten klinischen Studie wurde Onglyza bei gesunden Probanden einmal täglich 2 Wochen lang in Dosen von bis zu 400 mg täglich oral verabreicht (80-fache MRHD) hatten keine dosisabhängigen klinischen Nebenwirkungen und keine klinisch bedeutsamen Auswirkungen auf das QTc-Intervall oder das Herz Bewertung.
Im Falle einer Überdosierung sollte eine geeignete unterstützende Behandlung gemäß dem klinischen Status des Patienten eingeleitet werden. Saxagliptin und sein aktiver Metabolit werden durch Hämodialyse entfernt (23% der Dosis über 4 Stunden).
oben
Beschreibung
Saxagliptin ist ein oral wirksamer Inhibitor des DPP4-Enzyms.
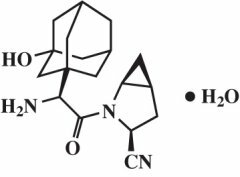
Saxagliptinmonohydrat wird chemisch als (1S, 3S, 5S) -2 - [(2S) -2-Amino-2- (3-hydroxytricyclo [3.3.1.1 beschrieben3,7] dec-1-yl) acetyl] -2-azabicyclo [3.1.0] hexan-3-carbonitril, monohydrat oder (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hydroxyadamantan - 1 - yl) acetyl] - 2 - azabicyclo [3.1.0] hexan - 3 - carbonitril Hydrat. Die empirische Formel lautet C18H25N3Ö2-H2O und das Molekulargewicht beträgt 333,43. Die Strukturformel lautet:
Saxagliptin-Monohydrat ist ein weißes bis hellgelbes oder hellbraunes, nicht hygroskopisches, kristallines Pulver. Es ist in Wasser bei 24 ° C ± 3 ° C schwer löslich, in Ethylacetat schwer löslich und in Methanol, Ethanol, Isopropylalkohol, Acetonitril, Aceton und Polyethylenglykol 400 (PEG 400) löslich.
Jede Filmtablette von Onglyza zum Einnehmen enthält entweder 2,79 mg Saxagliptinhydrochlorid (wasserfrei) entsprechend 2,5 mg Saxagliptin oder 5,58 mg Saxagliptin Hydrochlorid (wasserfrei) entsprechend 5 mg Saxagliptin und den folgenden inaktiven Bestandteilen: Lactose-Monohydrat, mikrokristalline Cellulose, Croscarmellose-Natrium und Magnesiumstearat. Zusätzlich enthält die Filmbeschichtung die folgenden inaktiven Bestandteile: Polyvinylalkohol, Polyethylenglykol, Titandioxid, Talk und Eisenoxide.
oben
Klinische Pharmakologie
Wirkmechanismus
Erhöhte Konzentrationen der Inkretinhormone wie Glucagon-ähnliches Peptid-1 (GLP-1) und Glucose-abhängig Insulinotropes Polypeptid (GIP) wird als Reaktion auf aus dem Dünndarm in den Blutkreislauf freigesetzt Mahlzeiten. Diese Hormone bewirken eine glukoseabhängige Insulinfreisetzung aus den Betazellen der Bauchspeicheldrüse, werden jedoch durch das Dipeptidylpeptidase-4 (DPP4) -Enzym innerhalb von Minuten inaktiviert. GLP-1 senkt auch die Glukagonsekretion aus Pankreas-Alpha-Zellen, wodurch die Glukoseproduktion in der Leber verringert wird. Bei Patienten mit Typ-2-Diabetes sind die Konzentrationen von GLP-1 verringert, die Insulinantwort auf GLP-1 bleibt jedoch erhalten. Saxagliptin ist ein kompetitiver DPP4-Hemmer, der die Inaktivierung der Inkretinhormone verlangsamt und dadurch deren Blutkreislauf erhöht Fasten und postprandiale Glukosekonzentrationen bei Patienten mit Typ-2-Diabetes glukoseabhängig senken Mellitus.
Pharmakodynamik
Bei Patienten mit Typ-2-Diabetes mellitus hemmt die Verabreichung von Onglyza die DPP4-Enzymaktivität über einen Zeitraum von 24 Stunden. Nach einer oralen Glukosebelastung oder einer Mahlzeit führte diese DPP4-Hemmung zu einem 2- bis 3-fachen Anstieg der zirkulierenden Wirkstoffspiegel GLP-1 und GIP verringerten die Glukagonkonzentrationen und erhöhten die glukoseabhängige Insulinsekretion aus Betazellen der Bauchspeicheldrüse. Der Anstieg des Insulins und die Abnahme des Glucagons waren mit niedrigeren Nüchternglucosekonzentrationen und einer verringerten Glucoseexkursion nach einer oralen Glucosebelastung oder einer Mahlzeit verbunden.
Herzelektrophysiologie
In einer randomisierten, doppelblinden, placebokontrollierten, aktiven 4-Wege-Crossover-Vergleichsstudie mit Moxifloxacin bei 40 gesunden Probanden Onglyza war nicht mit einer klinisch bedeutsamen Verlängerung des QTc-Intervalls oder der Herzfrequenz bei täglichen Dosen von bis zu 40 mg (8-fache) assoziiert MRHD).
Pharmakokinetik
Die Pharmakokinetik von Saxagliptin und seinem aktiven Metaboliten 5-Hydroxysaxagliptin war bei gesunden Probanden und bei Patienten mit Typ-2-Diabetes mellitus ähnlich. Die Cmax und die AUC-Werte von Saxagliptin und seinem aktiven Metaboliten stiegen proportional im Dosisbereich von 2,5 bis 400 mg an. Nach einer oralen Einzeldosis von 5 mg Saxagliptin bei gesunden Probanden betrugen die mittleren Plasma-AUC-Werte für Saxagliptin und seinen aktiven Metaboliten 78 ng-h / ml bzw. 214 ng-h / ml. Das entsprechende Plasma Cmax Die Werte betrugen 24 ng / ml bzw. 47 ng / ml. Die durchschnittliche Variabilität (% CV) für AUC und C.max sowohl für Saxagliptin als auch für seinen aktiven Metaboliten betrug weniger als 25%.
Bei wiederholter einmal täglicher Gabe bei jeder Dosisstufe wurde keine nennenswerte Anreicherung von Saxagliptin oder seines aktiven Metaboliten beobachtet. Bei der Clearance von Saxagliptin und seinem aktiven Metaboliten über 14 Tage einmal täglicher Gabe von Saxagliptin in Dosen im Bereich von 2,5 bis 400 mg wurde keine Dosis- und Zeitabhängigkeit beobachtet.
Absorption
Die mittlere Zeit bis zur maximalen Konzentration (T.max) nach 5 mg einmal täglich betrug die Dosis 2 Stunden für Saxagliptin und 4 Stunden für seinen aktiven Metaboliten. Die Verabreichung mit einer fettreichen Mahlzeit führte zu einem Anstieg von T.max von Saxagliptin um ungefähr 20 Minuten im Vergleich zu nüchternen Bedingungen. Es gab einen 27% igen Anstieg der AUC von Saxagliptin, wenn es mit einer Mahlzeit verabreicht wurde, im Vergleich zu nüchternen Bedingungen. Onglyza kann mit oder ohne Nahrung verabreicht werden.
Verteilung
Die in vitro Proteinbindung von Saxagliptin und seinem aktiven Metaboliten im menschlichen Serum ist vernachlässigbar. Daher wird nicht erwartet, dass Änderungen der Blutproteinspiegel bei verschiedenen Krankheitszuständen (z. B. Nieren- oder Leberfunktionsstörung) die Disposition von Saxagliptin verändern.
Stoffwechsel
Der Metabolismus von Saxagliptin wird hauptsächlich durch Cytochrom P450 3A4 / 5 (CYP3A4 / 5) vermittelt. Der Hauptmetabolit von Saxagliptin ist auch ein DPP4-Inhibitor, der halb so wirksam ist wie Saxagliptin. Daher verändern starke CYP3A4 / 5-Inhibitoren und Induktoren die Pharmakokinetik von Saxagliptin und seinem aktiven Metaboliten. [Sehen Wechselwirkungen mit anderen Medikamenten.]
Ausscheidung
Saxagliptin wird sowohl über die Nieren als auch über die Leber ausgeschieden. Nach einer Einzeldosis von 50 mg von 14C-Saxagliptin, 24%, 36% und 75% der Dosis wurden im Urin als Saxagliptin, sein aktiver Metabolit bzw. die gesamte Radioaktivität ausgeschieden. Die durchschnittliche renale Clearance von Saxagliptin (~ 230 ml / min) war größer als die durchschnittliche geschätzte glomeruläre Filtrationsrate (~ 120 ml / min), was auf eine aktive renale Ausscheidung hinweist. Insgesamt 22% der verabreichten Radioaktivität wurden im Kot gewonnen, was den Anteil der Saxagliptin-Dosis darstellt, der in die Galle und / oder das nicht absorbierte Arzneimittel aus dem Magen-Darm-Trakt ausgeschieden wird. Nach einer oralen Einzeldosis von 5 mg Onglyza bei gesunden Probanden wurde die mittlere Plasma-terminale Halbwertszeit (t1/2) für Saxagliptin und seinen aktiven Metaboliten betrug 2,5 bzw. 3,1 Stunden.
Spezifische Populationen
Nierenfunktionsstörung
Eine offene Einzeldosisstudie wurde durchgeführt, um die Pharmakokinetik von Saxagliptin (10 mg Dosis) in zu bewerten Probanden mit unterschiedlich starker chronischer Nierenfunktionsstörung (N = 8 pro Gruppe) im Vergleich zu Probanden mit normaler Nierenfunktionsstörung Funktion. Die Studie umfasste Patienten mit Nierenfunktionsstörungen, die aufgrund der Kreatinin-Clearance als mild (> 50 bis 80) eingestuft wurden ml / min), mittelschwer (30 bis 50 ml / min) und schwer (<30 ml / min) sowie Patienten mit Nierenerkrankungen im Endstadium Hämodialyse. Die Kreatinin-Clearance wurde aus Serumkreatinin basierend auf der Cockcroft-Gault-Formel geschätzt:
CrCl = [140 Jahre (Jahre)] - Gewicht (kg) {0,85 für weibliche Patienten}
[72 Serumkreatinin (mg / dl)]
Der Grad der Nierenfunktionsstörung hatte keinen Einfluss auf die Cmax von Saxagliptin oder seinem aktiven Metaboliten. Bei Patienten mit leichter Nierenfunktionsstörung waren die AUC-Werte von Saxagliptin und seinem aktiven Metaboliten 20% bzw. 70% höher als die AUC-Werte bei Patienten mit normaler Nierenfunktion. Da Erhöhungen dieser Größenordnung nicht als klinisch relevant angesehen werden, wird eine Dosisanpassung bei Patienten mit leichter Nierenfunktionsstörung nicht empfohlen. Bei Patienten mit mittelschwerer oder schwerer Nierenfunktionsstörung sind die AUC-Werte von Saxagliptin und seines Wirkstoffs Der Metabolit war bei Probanden mit normaler Nierenfunktion bis zu 2,1- bzw. 4,5-fach höher als die AUC-Werte Funktion. Zur Erzielung einer Plasmaexposition von Saxagliptin und seinem aktiven Metaboliten, ähnlich wie bei Patienten mit normaler Nierenfunktion, wird die empfohlene Dosis empfohlen beträgt 2,5 mg einmal täglich bei Patienten mit mittelschwerer und schwerer Nierenfunktionsstörung sowie bei Patienten mit Nierenerkrankungen im Endstadium, die eine Hämodialyse. Saxagliptin wird durch Hämodialyse entfernt.
Leberfunktionsstörung
Bei Patienten mit Leberfunktionsstörung (Child-Pugh-Klassen A, B und C) bedeutet Cmax und AUC von Saxagliptin waren bis zu 8% bzw. 77% höher im Vergleich zu gesunden, angepassten Kontrollen nach Verabreichung einer einzelnen 10 mg-Dosis Saxagliptin. Das entsprechende Cmax und AUC des aktiven Metaboliten waren bis zu 59% bzw. 33% niedriger im Vergleich zu gesunden, angepassten Kontrollen. Diese Unterschiede werden nicht als klinisch bedeutsam angesehen. Bei Patienten mit eingeschränkter Leberfunktion wird keine Dosisanpassung empfohlen.
Body Mass Index
Basierend auf dem Body Mass Index (BMI), der nicht als signifikant identifiziert wurde, wird keine Dosisanpassung empfohlen Kovariate über die scheinbare Clearance von Saxagliptin oder seines aktiven Metaboliten in der Populationspharmakokinetik Analyse.
Geschlecht
Es wird keine Dosisanpassung aufgrund des Geschlechts empfohlen. Es wurden keine Unterschiede in der Pharmakokinetik von Saxagliptin zwischen Männern und Frauen beobachtet. Im Vergleich zu Männern hatten Frauen ungefähr 25% höhere Expositionswerte für den aktiven Metaboliten als Männer, aber es ist unwahrscheinlich, dass dieser Unterschied von klinischer Relevanz ist. Das Geschlecht wurde in der populationspharmakokinetischen Analyse nicht als signifikante Kovariante für die scheinbare Clearance von Saxagliptin und seinem aktiven Metaboliten identifiziert.
Geriatrisch
Es wird keine Dosisanpassung allein aufgrund des Alters empfohlen. Ältere Probanden (65-80 Jahre) hatten ein um 23% und 59% höheres geometrisches Mittel Cmax bzw. geometrische Mittelwerte der AUC für Saxagliptin als junge Probanden (18-40 Jahre). Unterschiede in der Pharmakokinetik von aktiven Metaboliten zwischen älteren und jungen Probanden spiegeln im Allgemeinen die Unterschiede wider, die in der Pharmakokinetik von Saxagliptin beobachtet wurden. Der Unterschied zwischen der Pharmakokinetik von Saxagliptin und dem aktiven Metaboliten bei jungen und älteren Menschen Probanden ist wahrscheinlich auf mehrere Faktoren zurückzuführen, einschließlich einer abnehmenden Nierenfunktion und Stoffwechselkapazität mit zunehmendes Alter. Das Alter wurde in der populationspharmakokinetischen Analyse nicht als signifikante Kovariante für die scheinbare Clearance von Saxagliptin und seinem aktiven Metaboliten identifiziert
Pädiatrisch
Studien zur Pharmakokinetik von Saxagliptin bei pädiatrischen Patienten wurden nicht durchgeführt.
Rasse und Ethnizität
Je nach Rasse wird keine Dosisanpassung empfohlen. Die populationspharmakokinetische Analyse verglich die Pharmakokinetik von Saxagliptin und seines Wirkstoffs Metabolit bei 309 kaukasischen Probanden mit 105 nichtkaukasischen Probanden (bestehend aus sechs Rassen Gruppen). Zwischen diesen beiden Populationen wurde kein signifikanter Unterschied in der Pharmakokinetik von Saxagliptin und seinem aktiven Metaboliten festgestellt.
Arzneimittel-Wechselwirkungen
In-vitro-Bewertung von Arzneimittelwechselwirkungen
Der Metabolismus von Saxagliptin wird hauptsächlich durch CYP3A4 / 5 vermittelt.
In In-vitro-Studien hemmten Saxagliptin und sein aktiver Metabolit weder CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 oder 3A4 noch induzierten sie CYP1A2, 2B6, 2C9 oder 3A4. Daher ist nicht zu erwarten, dass Saxagliptin die metabolische Clearance von gemeinsam verabreichten Arzneimitteln verändert, die von diesen Enzymen metabolisiert werden. Saxagliptin ist ein P-Glykoprotein (P-gp) -Substrat, aber kein signifikanter Inhibitor oder Induktor von P-gp.
Die in vitro Proteinbindung von Saxagliptin und seinem aktiven Metaboliten im menschlichen Serum ist vernachlässigbar. Somit hätte die Proteinbindung keinen signifikanten Einfluss auf die Pharmakokinetik von Saxagliptin oder anderen Arzneimitteln.
In-vivo-Bewertung von Arzneimittelwechselwirkungen
Auswirkungen von Saxagliptin auf andere Arzneimittel
In Studien an gesunden Probanden, wie nachstehend beschrieben, änderte Saxagliptin die Wirkung von Saxagliptin nicht signifikant Pharmakokinetik von Metformin, Glyburid, Pioglitazon, Digoxin, Simvastatin, Diltiazem oder Ketoconazol.
Metformin: Die gleichzeitige Anwendung einer Einzeldosis von Saxagliptin (100 mg) und Metformin (1000 mg), einem hOCT-2-Substrat, veränderte die Pharmakokinetik von Metformin bei gesunden Probanden nicht. Onglyza ist daher kein Inhibitor des hOCT-2-vermittelten Transports.
Glyburid: Die gleichzeitige Verabreichung einer Einzeldosis von Saxagliptin (10 mg) und Glyburid (5 mg), einem CYP2C9-Substrat, erhöhte das Plasma Cmax von Glyburid um 16%; Die AUC von Glyburid blieb jedoch unverändert. Daher hemmt Onglyza den CYP2C9-vermittelten Metabolismus nicht signifikant.
Pioglitazon: Die gleichzeitige Verabreichung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Pioglitazon (45 mg), einem CYP2C8-Substrat, erhöhte das Plasma-Cmax von Pioglitazon um 14%; Die AUC von Pioglitazon blieb jedoch unverändert.
Digoxin: Die gleichzeitige Verabreichung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Digoxin (0,25 mg), einem P-gp-Substrat, änderte die Pharmakokinetik von Digoxin nicht. Daher ist Onglyza kein Inhibitor oder Induktor des P-gp-vermittelten Transports.
Simvastatin: Die gleichzeitige Anwendung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Simvastatin (40 mg), einem CYP3A4 / 5-Substrat, veränderte die Pharmakokinetik von Simvastatin nicht. Daher ist Onglyza kein Inhibitor oder Induktor des CYP3A4 / 5-vermittelten Metabolismus.
Diltiazem: Die gleichzeitige Verabreichung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Diltiazem (360 mg lang wirkende Formulierung im Steady-State), einem moderaten CYP3A4 / 5-Hemmer, erhöhte das Plasma Cmax von Diltiazem um 16%; Die AUC von Diltiazem blieb jedoch unverändert.
Ketoconazol: gleichzeitige Verabreichung einer Einzeldosis Saxagliptin (100 mg) und mehrerer Dosen Ketoconazol (200 mg alle 12 Stunden um Steady State), ein starker Inhibitor von CYP3A4 / 5 und P-gp, senkte die Cmax und AUC von Ketoconazol im Plasma um 16% und 13%. beziehungsweise.
Auswirkungen anderer Arzneimittel auf Saxagliptin
Metformin: Die gleichzeitige Verabreichung einer Einzeldosis von Saxagliptin (100 mg) und Metformin (1000 mg), einem hOCT-2-Substrat, senkte den Cmax von Saxagliptin um 21%; Die AUC blieb jedoch unverändert.
Glyburid: Die gleichzeitige Verabreichung einer Einzeldosis von Saxagliptin (10 mg) und Glyburid (5 mg), einem CYP2C9-Substrat, erhöhte den Cmax von Saxagliptin um 8%; Die AUC von Saxagliptin blieb jedoch unverändert.
Pioglitazon: gleichzeitige Verabreichung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Pioglitazon (45 mg), ein CYP2C8 (Haupt) - und CYP3A4 (Neben) -Substrat, änderte die Pharmakokinetik von nicht Saxagliptin.
Digoxin: Die gleichzeitige Anwendung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Digoxin (0,25 mg), einem P-gp-Substrat, veränderte die Pharmakokinetik von Saxagliptin nicht.
Simvastatin: Die gleichzeitige Verabreichung mehrerer einmal täglich verabreichter Dosen von Saxagliptin (10 mg) und Simvastatin (40 mg), einem CYP3A4 / 5-Substrat, erhöhte die Cmax von Saxagliptin um 21%; Die AUC von Saxagliptin blieb jedoch unverändert.
Diltiazem: Die gleichzeitige Gabe einer Einzeldosis von Saxagliptin (10 mg) und Diltiazem (360 mg langwirksame Formulierung im Steady-State), einem moderaten CYP3A4 / 5-Hemmer, erhöhte den C-Wertmax von Saxagliptin um 63% und die AUC um das 2,1-fache. Dies war mit einer entsprechenden Abnahme des C verbundenmax und AUC des aktiven Metaboliten um 44% bzw. 36%.
Ketoconazol: Die gleichzeitige Gabe einer Einzeldosis von Saxagliptin (100 mg) und Ketoconazol (200 mg alle 12 Stunden im Steady State), einem starken Inhibitor von CYP3A4 / 5 und P-gp, erhöhte den C-Wertmax für Saxagliptin um 62% und die AUC um das 2,5-fache. Dies war mit einer entsprechenden Abnahme des C verbundenmax und AUC des aktiven Metaboliten um 95% bzw. 91%.
In einer anderen Studie erhöhte die gleichzeitige Verabreichung einer Einzeldosis von Saxagliptin (20 mg) und Ketoconazol (200 mg alle 12 Stunden im Steady-State) den C-Wertmax und AUC von Saxagliptin um das 2,4-fache bzw. 3,7-fache. Dies war mit einer entsprechenden Abnahme des C verbundenmax und AUC des aktiven Metaboliten um 96% bzw. 90%.
Rifampin: Die gleichzeitige Gabe einer Einzeldosis Saxagliptin (5 mg) und Rifampin (600 mg QD im Steady-State) senkte den Cmax und AUC von Saxagliptin um 53% bzw. 76% mit einem entsprechenden Anstieg von Cmax (39%), aber keine signifikante Änderung der Plasma-AUC des aktiven Metaboliten.
Omeprazol: Gleichzeitige Verabreichung mehrerer einmal täglicher Dosen von Saxagliptin (10 mg) und Omeprazol (40 mg), einem CYP2C19 (Haupt-) und CYP3A4-Substrat, ein Inhibitor von CYP2C19 und ein Induktor von MRP-3, veränderten die Pharmakokinetik von nicht Saxagliptin.
Aluminiumhydroxid + Magnesiumhydroxid + Simethicon: gleichzeitige Verabreichung einer Einzeldosis Saxagliptin (10 mg) und a Flüssigkeit, die Aluminiumhydroxid (2400 mg), Magnesiumhydroxid (2400 mg) und Simethicon (240 mg) enthielt, verringerte das C.max von Saxagliptin um 26%; Die AUC von Saxagliptin blieb jedoch unverändert.
Famotidin: Die Verabreichung einer Einzeldosis Saxagliptin (10 mg) 3 Stunden nach einer Einzeldosis von Famotidin (40 mg), einem Inhibitor von hOCT-1, hOCT-2 und hOCT-3, erhöhte den Cmax von Saxagliptin um 14%; Die AUC von Saxagliptin blieb jedoch unverändert.
oben
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Fruchtbarkeitsstörung
Saxagliptin induzierte bei den höchsten bewerteten Dosen weder bei Mäusen (50, 250 und 600 mg / kg) noch bei Ratten (25, 75, 150 und 300 mg / kg) Tumore. Die höchsten Dosen, die bei Mäusen ausgewertet wurden, entsprachen ungefähr dem 870-fachen (Männer) und dem 1165-fachen (Frauen) der menschlichen Exposition bei der MRHD von 5 mg / Tag. Bei Ratten betrug die Exposition etwa das 355-fache (Männer) und das 2217-fache (Frauen) der MRHD.
Saxagliptin war in einem In-vitro-Ames-Bakterien-Assay, einem In-vitro-Cytogenetik-Assay beim primären Menschen, nicht mutagen oder klastogen mit oder ohne metabolische Aktivierung Lymphozyten, ein in vivo oraler Mikronukleus-Assay bei Ratten, eine in vivo orale DNA-Reparaturstudie an Ratten und eine orale in vivo / in vitro-Zytogenetikstudie an peripherem Blut von Ratten Lymphozyten. Der aktive Metabolit war in einem In-vitro-Ames-Bakterienassay nicht mutagen.
In einer Rattenfruchtbarkeitsstudie wurden Männer 2 Wochen vor der Paarung, während der Paarung und bis zum geplanten Zeitpunkt mit oralen Schlundsonden behandelt Beendigung (insgesamt ca. 4 Wochen) und Frauen wurden vor der Paarung während der Schwangerschaft 2 Wochen lang mit oralen Schlundsonden behandelt Tag 7. Bei Expositionen von ungefähr dem 603-fachen (Männer) und 776-fachen (Frauen) der MRHD wurden keine nachteiligen Auswirkungen auf die Fertilität beobachtet. Höhere Dosen, die eine maternale Toxizität hervorriefen, erhöhten auch die Resorptionen des Fötus (ungefähr das 2069- und 6138-fache der MRHD). Zusätzliche Auswirkungen auf den Östruszyklus, die Fruchtbarkeit, den Eisprung und die Implantation wurden bei etwa dem 6138-fachen der MRHD beobachtet.
Tiertoxikologie
Saxagliptin verursachte nachteilige Hautveränderungen an den Extremitäten von Cynomolgus-Affen (Krusten und / oder Geschwüre von Schwanz, Ziffern, Hodensack und / oder Nase). Hautläsionen waren beim 20-fachen der MRHD reversibel, in einigen Fällen jedoch irreversibel und nekrotisierend bei höheren Expositionen. Unerwünschte Hautveränderungen wurden bei Expositionen ähnlich der (1 bis 3-fachen) MRHD von 5 mg nicht beobachtet. Klinische Korrelate zu Hautläsionen bei Affen wurden in klinischen Studien mit Saxagliptin am Menschen nicht beobachtet.
oben
Klinische Studien
Onglyza wurde als Monotherapie und in Kombination mit Metformin, Glyburid und Thiazolidindion (Pioglitazon und Rosiglitazon) untersucht. Onglyza wurde nicht in Kombination mit Insulin untersucht.
Insgesamt 4148 Patienten mit Typ-2-Diabetes mellitus wurden in sechs doppelblinden, kontrollierten klinischen Studien randomisiert, die durchgeführt wurden, um die Sicherheit und die glykämische Wirksamkeit von Onglyza zu bewerten. Insgesamt 3021 Patienten in diesen Studien wurden mit Onglyza behandelt. In diesen Studien betrug das Durchschnittsalter 54 Jahre, und 71% der Patienten waren Kaukasier, 16% waren Asiaten, 4% waren Schwarze und 9% gehörten anderen Rassengruppen an. Weitere 423 Patienten, darunter 315 Patienten, die Onglyza erhielten, nahmen an einer placebokontrollierten, dosisabhängigen Studie mit einer Dauer von 6 bis 12 Wochen teil.
In diesen sechs Doppelblindstudien wurde Onglyza in Dosen von 2,5 mg und 5 mg einmal täglich bewertet. In drei dieser Studien wurde auch eine Saxagliptin-Dosis von 10 mg täglich bewertet. Die tägliche Dosis von 10 mg Saxagliptin ergab keine größere Wirksamkeit als die tägliche Dosis von 5 mg. Die Behandlung mit Onglyza in allen Dosen führte zu klinisch relevanten und statistisch signifikanten Verbesserungen des Hämoglobins A1c (A1C). Nüchternplasmaglukose (FPG) und 2 Stunden postprandiale Glukose (PPG) nach einem standardmäßigen oralen Glukosetoleranztest (OGTT) im Vergleich zu Steuerung. Eine Verringerung der A1C wurde in allen Untergruppen beobachtet, einschließlich Geschlecht, Alter, Rasse und Basis-BMI.
Onglyza war im Vergleich zu Placebo nicht mit signifikanten Veränderungen des Körpergewichts oder der Nüchtern-Serumlipide gegenüber dem Ausgangswert assoziiert.
Monotherapie
Insgesamt 766 Patienten mit Typ-2-Diabetes wurden in Bezug auf Ernährung und Bewegung unzureichend kontrolliert (A1C - 7% bis 10%). nahm an zwei 24-wöchigen, doppelblinden, placebokontrollierten Studien teil, in denen die Wirksamkeit und Sicherheit von Onglyza bewertet wurde Monotherapie.
In der ersten Studie wurden nach einer zweiwöchigen Single-Blind-Diät, Bewegung und Placebo-Einführungsphase 401 Patienten auf 2,5 mg, 5 mg oder 10 mg Onglyza oder Placebo randomisiert. Patienten, die während der Studie bestimmte glykämische Ziele nicht erreichten, wurden mit einer Metformin-Rettungstherapie behandelt, die zusätzlich zu Placebo oder Onglyza angewendet wurde. Die Wirksamkeit wurde bei der letzten Messung vor der Rettungstherapie für Patienten bewertet, die eine Rettung benötigen. Eine Dosistitration von Onglyza war nicht zulässig.
Die Behandlung mit Onglyza 2,5 mg und 5 mg täglich ergab signifikante Verbesserungen bei A1C, FPG und PPG im Vergleich zu Placebo (Tabelle 3). Der Prozentsatz der Patienten, die wegen mangelnder Blutzuckerkontrolle abgesetzt wurden oder aufgrund eines festgelegten Treffens gerettet wurden Die glykämischen Kriterien betrugen 16% in der Onglyza 2,5 mg-Behandlungsgruppe, 20% in der Onglyza 5 mg-Behandlungsgruppe und 26% in der Placebo-Gruppe.
Tabelle 3: Glykämische Parameter in Woche 24 in einer placebokontrollierten Studie zur Onglyza-Monotherapie bei Patienten mit Typ-2-Diabetes *
| Wirksamkeitsparameter | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Intent-to-Treat-Population unter Verwendung der letzten Beobachtung in der Studie oder der letzten Beobachtung vor der Metformin-Rettungstherapie für Patienten, die eine Rettung benötigen. | |||
| †Mittelwert der kleinsten Quadrate, angepasst an den Basiswert. | |||
| c p-Wert <0,0001 im Vergleich zu Placebo | |||
| § p-Wert <0,05 im Vergleich zu Placebo | |||
| ¶ Die Signifikanz wurde für das 2-Stunden-PPG für die 2,5-mg-Dosis von Onglyza nicht getestet. | |||
| Hämoglobin a1c (%) | N = 100 | N = 103 | N = 92 |
| Grundlinie (Mittelwert) | 7.9 | 8.0 | 7.9 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −0.4 | −0.5 | +0.2 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −0.6c | −0.6c | |
| 95% Konfidenzintervall | (−0.9, −0.3) | (−0.9, −0.4) | |
| Anteil der Patienten mit A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Nüchternplasmaglukose (mg / dl) | N = 101 | N = 105 | N = 92 |
| Grundlinie (Mittelwert) | 178 | 171 | 172 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −15 | −9 | +6 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −21 § | −15 § | |
| 95% Konfidenzintervall | (−31, −10) | (−25, −4) | |
| 2 Stunden postprandiale Glukose (mg / dl) | N = 78 | N = 84 | N = 71 |
| Grundlinie (Mittelwert) | 279 | 278 | 283 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −45 | −43 | −6 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −39 ¶ | −37 § | |
| 95% Konfidenzintervall | (−61, −16) | (−59, −15) |
Eine zweite 24-wöchige Monotherapie-Studie wurde durchgeführt, um eine Reihe von Dosierungsschemata für Onglyza zu bewerten. Bei nicht vorbehandelten Patienten mit unzureichend kontrolliertem Diabetes (A1C - 7% bis 10%) wurde eine zweiwöchige Einblind-Diät, Bewegung und Placebo-Einführungsphase durchgeführt. Insgesamt 365 Patienten wurden randomisiert auf 2,5 mg jeden Morgen, 5 mg jeden Morgen, 2,5 mg mit möglicher Titration auf 5 mg jeden Morgen oder 5 mg jeden Abend von Onglyza oder Placebo. Patienten, die während der Studie bestimmte glykämische Ziele nicht erreichten, wurden mit einer Metformin-Rettungstherapie behandelt, die Placebo oder Onglyza zugesetzt wurde. Die Anzahl der pro Behandlungsgruppe randomisierten Patienten lag zwischen 71 und 74.
Die Behandlung mit Onglyza 5 mg jeden Morgen oder 5 mg jeden Abend führte zu einer signifikanten Verbesserung der A1C gegenüber Placebo (mittlere placebokorrigierte Reduktion von 0,4% bzw. 0,3%). Die morgendliche Behandlung mit 2,5 mg Onglyza führte auch zu einer signifikanten Verbesserung der A1C gegenüber Placebo (mittlere placebokorrigierte Reduktion von 0,4%).
Kombinationstherapie
Add-On-Kombinationstherapie mit Metformin
Insgesamt 743 Patienten mit Typ-2-Diabetes nahmen an dieser 24-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie teil, um die Wirksamkeit und Sicherheit von Onglyza in Kombination mit Metformin bei Patienten mit unzureichender Blutzuckerkontrolle (A1C ¥ 7% und ¤ 10%) unter Metformin allein. Um sich für die Aufnahme zu qualifizieren, mussten die Patienten mindestens 8 Wochen lang eine stabile Dosis Metformin (1500-2550 mg täglich) erhalten.
Patienten, die die Zulassungskriterien erfüllten, wurden in ein einblindiges, zweiwöchiges Placebo-Lead-In für Ernährung und Bewegung eingeschlossen Zeitraum, in dem Patienten Metformin in ihrer Dosis vor der Studie, bis zu 2500 mg täglich, für die Dauer der Behandlung erhielten Studie. Nach der Einführungsphase wurden in Frage kommende Patienten zusätzlich zu ihrer aktuellen Dosis von offenem Metformin auf 2,5 mg, 5 mg oder 10 mg Onglyza oder Placebo randomisiert. Patienten, die während der Studie bestimmte glykämische Ziele nicht erreichten, wurden mit einer Pioglitazon-Rettungstherapie behandelt, die zu bestehenden Studienmedikamenten hinzugefügt wurde. Dosistitrationen von Onglyza und Metformin waren nicht zulässig.
Die Zugabe von 2,5 mg und 5 mg Onglyza zu Meformin führte zu einer signifikanten Verbesserung von A1C, FPG und PPG im Vergleich zur Placebo-Zugabe zu Metformin (Tabelle 4). Die mittleren Änderungen gegenüber der Basislinie für A1C über die Zeit und am Endpunkt sind in Abbildung 1 dargestellt. Der Anteil der Patienten, die wegen mangelnder Blutzuckerkontrolle abgesetzt oder wegen Erfüllung der vorgegebenen Blutzuckerkriterien gerettet wurden, betrug 15% in der Onglyza 2,5 mg Add-On zur Metformin-Gruppe, 13% in der Onglyza 5 mg Add-On zur Metformin-Gruppe und 27% in der Placebo-Add-On zur Metformin-Gruppe Gruppe.
Tabelle 4: Glykämische Parameter in Woche 24 in einer placebokontrollierten Studie über Onglyza als Kombinationstherapie mit Metformin *
| Wirksamkeitsparameter | Onglyza 2,5 mg + Metformin N = 192 |
Onglyza 5 mg + Metformin N = 191 |
Placebo + Metformin N = 179 |
|---|---|---|---|
| * Zur Behandlung der Bevölkerung unter Verwendung der letzten Beobachtung in der Studie oder der letzten Beobachtung vor der Pioglitazon-Rettungstherapie für Patienten, die einer Rettung bedürfen. | |||
| †Mittelwert der kleinsten Quadrate, angepasst an den Basiswert. | |||
| c p-Wert <0,0001 im Vergleich zu Placebo + Metformin | |||
| § p-Wert <0,05 im Vergleich zu Placebo + Metformin | |||
| Hämoglobin a1c (%) | N = 186 | N = 186 | N = 175 |
| Grundlinie (Mittelwert) | 8.1 | 8.1 | 8.1 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −0.6 | −0.7 | +0.1 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −0.7c | −0.8c | |
| 95% Konfidenzintervall | (−0.9, −0.5) | (−1.0, −0.6) | |
| Anteil der Patienten mit A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Nüchternplasmaglukose (mg / dl) | N = 188 | N = 187 | N = 176 |
| Grundlinie (Mittelwert) | 174 | 179 | 175 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −14 | −22 | +1 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −16 § | −23 § | |
| 95% Konfidenzintervall | (−23, −9) | (−30, −16) | |
| 2 Stunden postprandiale Glukose (mg / dl) | N = 155 | N = 155 | N = 135 |
| Grundlinie (Mittelwert) | 294 | 296 | 295 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −62 | −58 | −18 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −44 § | −40 § | |
| 95% Konfidenzintervall | (−60, −27) | (−56, −24) |
Abbildung 1: Mittlere Änderung gegenüber dem Ausgangswert bei A1C in einer Placebo-kontrollierten Studie mit Onglyza als Add-On-Kombinationstherapie mit Metformin *

* Beinhaltet Patienten mit einem Ausgangswert und einem Wert für Woche 24.
Woche 24 (LOCF) umfasst Patienten, die vor der Pioglitazon-Notfalltherapie eine Notfalltherapie benötigen. Die mittlere Änderung gegenüber der Basislinie wird an den Basislinienwert angepasst.
Add-On-Kombinationstherapie mit einem Thiazolidindion
Insgesamt 565 Patienten mit Typ-2-Diabetes nahmen an dieser 24-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie teil, um die Wirksamkeit und Sicherheit von Onglyza in Kombination mit einem Thiazolidindion (TZD) bei Patienten mit unzureichender Blutzuckerkontrolle (A1C - 7% bis 10,5%) TZD alleine. Um sich für die Aufnahme zu qualifizieren, mussten die Patienten eine stabile Dosis Pioglitazon (30-45 mg einmal täglich) erhalten. oder Rosiglitazon (4 mg einmal täglich oder 8 mg entweder einmal täglich oder in zwei aufgeteilten Dosen von 4 mg) für mindestens 12 Wochen.
Patienten, die die Zulassungskriterien erfüllten, nahmen an einer einblinden, zweiwöchigen Diät und sportlichen Betätigung teil Placebo-Einführungszeitraum, in dem die Patienten TZD in der Dosis vor der Studie für die Dauer der Behandlung erhielten Studie. Nach der Einführungsphase wurden in Frage kommende Patienten zusätzlich zu ihrer aktuellen TZD-Dosis auf 2,5 mg oder 5 mg Onglyza oder Placebo randomisiert. Patienten, die bestimmte glykämische Ziele während der Studie nicht erreichten, wurden mit Metformin Rescue behandelt, das zu den bestehenden Studienmedikamenten hinzugefügt wurde. Eine Dosistitration von Onglyza oder TZD war während der Studie nicht zulässig. Eine Änderung des TZD-Regimes von Rosiglitazon zu Pioglitazon bei festgelegten, äquivalenten therapeutischen Dosen war nach Ermessen des Prüfers zulässig, wenn dies als medizinisch angemessen erachtet wurde.
Onglyza 2,5 mg und 5 mg Add-On zu TZD lieferten signifikante Verbesserungen bei A1C, FPG und PPG im Vergleich zu Placebo-Add-On zu TZD (Tabelle 5). Der Anteil der Patienten, die wegen mangelnder Blutzuckerkontrolle abgesetzt oder wegen Erfüllung der festgelegten Blutzuckerkriterien gerettet wurden betrug 10% im Onglyza 2,5 mg-Zusatz zur TZD-Gruppe, 6% im Onglyza 5 mg-Zusatz zur TZD-Gruppe und 10% im Placebo-Zusatz zur TZD Gruppe.
Tabelle 5: Glykämische Parameter in Woche 24 in einer placebokontrollierten Studie zu Onglyza als Zusatzkombinationstherapie mit einem Thiazolidindion *
| Wirksamkeitsparameter | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Intent-to-Treat-Population unter Verwendung der letzten Beobachtung in der Studie oder der letzten Beobachtung vor der Metformin-Rettungstherapie für Patienten, die eine Rettung benötigen. | |||
| †Mittelwert der kleinsten Quadrate, angepasst an den Basiswert. | |||
| c p-Wert <0,0001 im Vergleich zu Placebo + TZD | |||
| § p-Wert <0,05 im Vergleich zu Placebo + TZD | |||
| Hämoglobin a1c (%) | N = 192 | N = 183 | N = 180 |
| Grundlinie (Mittelwert) | 8.3 | 8.4 | 8.2 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −0.7 | −0.9 | −0.3 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −0.4 § | −0.6c | |
| 95% Konfidenzintervall | (−0.6, −0.2) | (−0.8, −0.4) | |
| Anteil der Patienten mit A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Nüchternplasmaglukose (mg / dl) | N = 193 | N = 185 | N = 181 |
| Grundlinie (Mittelwert) | 163 | 160 | 162 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −14 | −17 | −3 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −12 § | −15 § | |
| 95% Konfidenzintervall | (−20, −3) | (−23, −6) | |
| 2 Stunden postprandiale Glukose (mg / dl) | N = 156 | N = 134 | N = 127 |
| Grundlinie (Mittelwert) | 296 | 303 | 291 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −55 | −65 | −15 |
| Unterschied zum Placebo (angepasster Mittelwert†) | −40 § | −50 § | |
| 95% Konfidenzintervall | (−56, −24) | (−66, −34) |
Add-On-Kombinationstherapie mit Glyburid
Insgesamt 768 Patienten mit Typ-2-Diabetes nahmen an dieser 24-wöchigen randomisierten, doppelblinden, placebokontrollierten Studie teil, um die Wirksamkeit und Sicherheit zu bewerten von Onglyza in Kombination mit einem Sulfonylharnstoff (SU) bei Patienten mit unzureichender Blutzuckerkontrolle bei der Aufnahme (A1C - 7,5% bis 10%) in einer submaximalen Dosis von SU allein. Um sich für die Aufnahme zu qualifizieren, mussten die Patienten mindestens 2 Monate lang eine submaximale SU-Dosis erhalten. In dieser Studie wurde Onglyza in Kombination mit einer festen mittleren SU-Dosis mit der Titration einer höheren SU-Dosis verglichen.
Patienten, die die Zulassungskriterien erfüllten, wurden in einer 4-wöchigen Einführungsphase mit Diät und körperlicher Betätigung für einen Blindversuch eingeschlossen und erhielten einmal täglich 7,5 mg Glyburid. Nach der Einführungsphase wurden in Frage kommende Patienten mit A1C von 7% bis 10% auf 2,5 randomisiert mg oder 5 mg Onglyza-Zusatz zu 7,5 mg Glyburid oder Placebo plus einer täglichen Gesamtdosis von 10 mg Glyburid. Patienten, die ein Placebo erhielten, konnten Glyburid auf eine tägliche Gesamtdosis von 15 mg hochtitrieren lassen. Eine Up-Titration von Glyburid war bei Patienten, die Onglyza 2,5 mg oder 5 mg erhielten, nicht zulässig. Während des 24-wöchigen Untersuchungszeitraums konnte Glyburid in jeder Behandlungsgruppe aufgrund einer vom Prüfer als notwendig erachteten Hypoglykämie einmal herunter titriert werden. Ungefähr 92% der Patienten in der Placebo-plus-Glyburid-Gruppe wurden in den ersten 4 Wochen des Studienzeitraums auf eine endgültige tägliche Gesamtdosis von 15 mg hochtitriert. Patienten, die bestimmte glykämische Ziele während der Studie nicht erreichten, wurden mit Metformin Rescue behandelt, das zusätzlich zu den vorhandenen Studienmedikamenten verabreicht wurde. Eine Dosistitration von Onglyza war während der Studie nicht zulässig.
In Kombination mit Glyburid zeigten Onglyza 2,5 mg und 5 mg signifikante Verbesserungen bei A1C, FPG und PPG im Vergleich zur Placebo plus hochtitrierten Glyburidgruppe (Tabelle 6). Der Anteil der Patienten, die wegen mangelnder Blutzuckerkontrolle abgesetzt oder wegen Erfüllung der vorgegebenen Blutzuckerkriterien gerettet wurden, betrug 18% in das Onglyza 2,5 mg-Add-On zur Glyburid-Gruppe, 17% bei dem Onglyza 5 mg-Add-On zur Glyburid-Gruppe und 30% bei dem Placebo plus hochtitriertem Glyburid Gruppe.
Tabelle 6: Glykämische Parameter in Woche 24 in einer placebokontrollierten Studie über Onglyza als Kombinationstherapie mit Glyburid *
| Wirksamkeitsparameter | Onglyza 2,5 mg + Glyburide 7,5 mg N = 248 |
Onglyza 5 mg + Glyburide 7,5 mg N = 253 |
Placebo + Up-Titrated Glyburide N = 267 |
|---|---|---|---|
| * Intent-to-Treat-Population unter Verwendung der letzten Beobachtung in der Studie oder der letzten Beobachtung vor der Metformin-Rettungstherapie für Patienten, die eine Rettung benötigen. | |||
| †Mittelwert der kleinsten Quadrate, angepasst an den Basiswert. | |||
| c p-Wert <0,0001 im Vergleich zu Placebo + hochtitriertem Glyburid | |||
| § p-Wert <0,05 im Vergleich zu Placebo + hochtitriertem Glyburid | |||
| Hämoglobin a1c (%) | N = 246 | N = 250 | N = 264 |
| Grundlinie (Mittelwert) | 8.4 | 8.5 | 8.4 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −0.5 | −0.6 | +0.1 |
| Unterschied zu hochtitriertem Glyburid (angepasster Mittelwert)†) | −0.6c | −0.7c | |
| 95% Konfidenzintervall | (−0.8, −0.5) | (−0.9, −0.6) | |
| Anteil der Patienten mit A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Nüchternplasmaglukose (mg / dl) | N = 247 | N = 252 | N = 265 |
| Grundlinie (Mittelwert) | 170 | 175 | 174 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −7 | −10 | +1 |
| Unterschied zu hochtitriertem Glyburid (angepasster Mittelwert)†) | −8 § | −10 § | |
| 95% Konfidenzintervall | (−14, −1) | (−17, −4) | |
| 2 Stunden postprandiale Glukose (mg / dl) | N = 195 | N = 202 | N = 206 |
| Grundlinie (Mittelwert) | 309 | 315 | 323 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −31 | −34 | +8 |
| Unterschied zu hochtitriertem Glyburid (angepasster Mittelwert)†) | −38 § | −42 § | |
| 95% Konfidenzintervall | (−50, −27) | (−53, −31) |
Gleichzeitige Anwendung mit Metformin bei therapienaiven Patienten
Insgesamt 1306 therapienaive Patienten mit Typ-2-Diabetes mellitus nahmen an dieser 24-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie teil Bewertung der Wirksamkeit und Sicherheit von Onglyza zusammen mit Metformin bei Patienten mit unzureichender Blutzuckerkontrolle (A1C - 8% bis 12%) in Bezug auf Ernährung und Bewegung allein. Die Patienten mussten behandlungsnaiv sein, um an dieser Studie teilnehmen zu können.
Patienten, die die Zulassungskriterien erfüllten, wurden in eine 1-wöchige Einblind-, Diät- und Übungs-Placebo-Einführungsphase aufgenommen. Die Patienten wurden in einen von vier Behandlungsarmen randomisiert: Onglyza 5 mg + Metformin 500 mg, Saxagliptin 10 mg + Metformin 500 mg, Saxagliptin 10 mg + Placebo oder Metformin 500 mg + Placebo. Onglyza wurde einmal täglich verabreicht. In den 3 Behandlungsgruppen, in denen Metformin angewendet wurde, wurde die Metformin-Dosis wöchentlich in tolerierten Schritten von 500 mg pro Tag auf ein Maximum von 2000 mg pro Tag, basierend auf FPG, erhöht. Patienten, die während der Studien bestimmte glykämische Ziele nicht erreichten, wurden als Zusatztherapie mit Pioglitazon-Rescue behandelt.
Die gleichzeitige Anwendung von 5 mg Onglyza plus Metformin führte zu signifikanten Verbesserungen bei A1C, FPG und PPG im Vergleich zu Placebo plus Metformin (Tabelle 7).
Tabelle 7: Glykämische Parameter in Woche 24 in einer placebokontrollierten Studie zur Onglyza-Coadministration mit Metformin bei behandlungsnahen Patienten
| Wirksamkeitsparameter | Onglyza 5 mg + Metformin N = 320 |
Placebo + Metformin N = 328 |
|---|---|---|
| * Zur Behandlung der Bevölkerung unter Verwendung der letzten Beobachtung in der Studie oder der letzten Beobachtung vor der Pioglitazon-Rettungstherapie für Patienten, die einer Rettung bedürfen. | ||
| †Mittelwert der kleinsten Quadrate, angepasst an den Basiswert. | ||
| c p-Wert <0,0001 im Vergleich zu Placebo + Metformin | ||
| § p-Wert <0,05 im Vergleich zu Placebo + Metformin | ||
| Hämoglobin a1c (%) | N = 306 | N = 313 |
| Grundlinie (Mittelwert) | 9.4 | 9.4 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −2.5 | −2.0 |
| Differenz von Placebo + Metformin (bereinigter Mittelwert)†) | −0.5c | |
| 95% Konfidenzintervall | (−0.7, −0.4) | |
| Anteil der Patienten mit A1C <7% | 60% §(185/307) | 41% (129/314) |
| Nüchternplasmaglukose (mg / dl) | N = 315 | N = 320 |
| Grundlinie (Mittelwert) | 199 | 199 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −60 | −47 |
| Differenz von Placebo + Metformin (bereinigter Mittelwert)†) | −13 § | |
| 95% Konfidenzintervall | (−19, −6) | |
| 2 Stunden postprandiale Glukose (mg / dl) | N = 146 | N = 141 |
| Grundlinie (Mittelwert) | 340 | 355 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)†) | −138 | −97 |
| Differenz von Placebo + Metformin (bereinigter Mittelwert)†) | −41 § | |
| 95% Konfidenzintervall | (−57, −25) |
oben
Wie geliefert
Onglyza ™ -Tabletten (Saxagliptin) sind auf beiden Seiten mit Markierungen versehen und in den in Tabelle 8 aufgeführten Stärken und Packungen erhältlich.
| Tablette Stärke |
Filmtablette Farbe / Form |
Tablette Markierungen |
Packungsgrösse | NDC-Code |
|---|---|---|---|---|
| 5 mg | Rosa bikonvex, rund |
"5" auf einer Seite und "4215" auf der Rückseite, in blauer Tinte | Flaschen von 30 Flaschen von 90 Flaschen von 500 Blister von 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | hellgelb bis hellgelb bikonvex, rund |
"2.5" auf einer Seite und "4214" auf der Rückseite, in blauer Tinte | Flaschen von 30 Flaschen von 90 |
0003-4214-11 0003-4214-21 |
Lagerung und Handhabung
Bei 20-25 ° C lagern; zulässige Abweichungen von 15 ° -30 ° C (59 ° -86 ° F) [siehe USP Controlled Room Temperature].
oben
Letzte Aktualisierung: 07/09
E. R. Squibb & Sons, L.L.C.
Onglyza Patienteninformation
Detaillierte Informationen zu Anzeichen, Symptomen, Ursachen und Behandlungen von Diabetes
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
zurück zu: Durchsuchen Sie alle Medikamente für Diabetes



