NovoLog zur Behandlung von Diabetes
Markenname: NovoLog
Generischer Name: Insulinaspart
Darreichungsform: Injektion
Inhalt:
Indikationen und Verwendung
Dosierung und Anwendung
Darreichungsformen und Stärken
Kontraindikationen
Warnungen und Vorsichtsmaßnahmen
Nebenwirkungen
Wechselwirkungen mit anderen Medikamenten
Verwendung in bestimmten Populationen
Überdosierung
Beschreibung
Klinische Pharmakologie
Nichtklinische Toxikologie
Klinische Studien
Wie geliefert / Lagerung und Handhabung
NovoLog, Insulinaspart, Patienteninformation (in reinem Englisch)
Indikationen und Verwendung
Behandlung von Diabetes mellitus
NovoLog ist ein Insulinanalogon, das zur Verbesserung der Blutzuckerkontrolle bei Erwachsenen und Kindern mit Diabetes mellitus angezeigt ist.
oben
Dosierung und Anwendung
Dosierung
NovoLog ist ein Insulinanalogon mit einem früheren Wirkungseintritt als normales Humaninsulin. Die Dosierung von NovoLog muss individuell angepasst werden. NovoLog, das durch subkutane Injektion verabreicht wird, sollte im Allgemeinen in Regimen mit einem mittel- oder langwirksamen Insulin angewendet werden [siehe
Warnungen und Vorsichtsmaßnahmen, Lieferform / Lagerung und Handhabung]. Der tägliche Gesamtinsulinbedarf kann variieren und liegt normalerweise zwischen 0,5 und 1,0 Einheiten / kg / Tag. Bei Anwendung in einer mahlzeitbezogenen subkutanen Injektionsbehandlung 50 bis 70% des Gesamtinsulins Anforderungen können von NovoLog und der Rest von einem Zwischenwirkenden bereitgestellt werden oder lang wirkendes Insulin. Aufgrund des vergleichsweise schnellen Einsetzens von NovoLog und der kurzen Dauer der Aktivität zur Senkung der Glukose benötigen einige Patienten möglicherweise mehr Basalinsulin und mehr Gesamtinsulin zur Vorbeugung von Hyperglykämie vor der Mahlzeit bei Verwendung von NovoLog als bei regelmäßiger Anwendung beim Menschen Insulin.Verwenden Sie NovoLog nicht, das viskos (verdickt) oder trüb ist. Nur verwenden, wenn es klar und farblos ist. NovoLog sollte nicht nach dem gedruckten Ablaufdatum verwendet werden.
Subkutane Injektion
NovoLog sollte durch subkutane Injektion in den Bauchbereich, das Gesäß, den Oberschenkel oder den Oberarm verabreicht werden. Da NovoLog schneller einsetzt und eine kürzere Aktivitätsdauer aufweist als normales Humaninsulin, sollte es unmittelbar (innerhalb von 5 bis 10 Minuten) vor einer Mahlzeit injiziert werden. Die Injektionsstellen sollten innerhalb derselben Region gedreht werden, um das Risiko einer Lipodystrophie zu verringern. Wie bei allen Insulinen variiert die Wirkdauer von NovoLog je nach Dosis, Injektionsstelle, Blutfluss, Temperatur und körperlicher Aktivität.
NovoLog kann zur subkutanen Injektion mit Insulinverdünnungsmedium für NovoLog verdünnt werden. Das Verdünnen eines Teils NovoLog auf neun Teile Verdünnungsmittel ergibt eine Konzentration von einem Zehntel der von NovoLog (entspricht U-10). Wenn Sie einen Teil NovoLog auf einen Teil Verdünnungsmittel verdünnen, erhalten Sie eine Konzentration, die halb so hoch ist wie die von NovoLog (entspricht U-50).
Kontinuierliche subkutane Insulininfusion (CSII) durch externe Pumpe
NovoLog kann auch subkutan mit einer externen Insulinpumpe infundiert werden [siehe Warnungen und Vorsichtsmaßnahmen, Lieferform / Lagerung und Handhabung]. Verdünntes Insulin sollte nicht in externen Insulinpumpen verwendet werden. Da NovoLog schneller einsetzt und eine kürzere Aktivitätsdauer aufweist als normales Humaninsulin, sollten NovoLog-Boli vor der Mahlzeit unmittelbar (innerhalb von 5 bis 10 Minuten) vor einer Mahlzeit infundiert werden. Die Infusionsstellen sollten innerhalb derselben Region gedreht werden, um das Risiko einer Lipodystrophie zu verringern. Die anfängliche Programmierung der externen Insulininfusionspumpe sollte auf der täglichen Gesamtinsulindosis des vorherigen Regimes basieren. Obwohl es eine signifikante Variabilität zwischen Patienten gibt, werden ungefähr 50% der Gesamtdosis normalerweise als mahlzeitbedingte Boli von NovoLog und der Rest als Basalinfusion verabreicht. Wechseln Sie den NovoLog mindestens alle 48 Stunden im Reservoir, in den Infusionssets und an der Einführstelle des Infusionssets.
Intravenöse Anwendung
NovoLog kann zur Blutzuckerkontrolle unter ärztlicher Aufsicht intravenös verabreicht werden, wobei der Blutzucker- und Kaliumspiegel engmaschig überwacht werden muss, um Hypoglykämie und Hypokaliämie zu vermeiden [siehe Warnungen und Vorsichtsmaßnahmen, Lieferform / Lagerung und Handhabung]. Zur intravenösen Anwendung sollte NovoLog in Konzentrationen von 0,05 U / ml bis 1,0 U / ml Insulinaspart in Infusionssystemen unter Verwendung von Polypropylen-Infusionsbeuteln angewendet werden. Es wurde gezeigt, dass NovoLog in Infusionsflüssigkeiten wie 0,9% Natriumchlorid stabil ist.
Untersuchen Sie NovoLog vor der parenteralen Verabreichung auf Partikel und Verfärbungen.
oben
Darreichungsformen und Stärken
NovoLog ist in folgenden Packungsgrößen erhältlich: Jede Präsentation enthält 100 Einheiten Insulin-Aspart pro ml (U-100).
- 10 ml Fläschchen
- 3-ml-PenFill-Kartuschen für das 3-ml-PenFill-Kartuschen-Abgabegerät (mit oder ohne Zusatz eines NovoPen® 3 PenMate®) mit NovoFine®-Einwegnadeln
- 3 ml NovoLog FlexPen Fertigspritze
oben
Kontraindikationen
NovoLog ist kontraindiziert
- während Episoden von Hypoglykämie
- bei Patienten mit Überempfindlichkeit gegen NovoLog oder einen seiner Hilfsstoffe.
oben
Warnungen und Vorsichtsmaßnahmen
Verwaltung
NovoLog hat einen schnelleren Wirkungseintritt und eine kürzere Aktivitätsdauer als normales Humaninsulin. Nach einer NovoLog-Injektion sollte innerhalb von 5 bis 10 Minuten eine Mahlzeit erfolgen. Aufgrund der kurzen Wirkdauer von NovoLog sollte bei Patienten mit Typ-1-Diabetes auch ein länger wirkendes Insulin angewendet werden. Bei Patienten mit Typ-2-Diabetes kann dies ebenfalls erforderlich sein. Die Glukoseüberwachung wird für alle Patienten mit Diabetes empfohlen und ist besonders wichtig für Patienten, die eine externe Pumpeninfusionstherapie anwenden.
Jede Änderung der Insulindosis sollte vorsichtig und nur unter ärztlicher Aufsicht erfolgen. Ein Wechsel von einem Insulinprodukt zu einem anderen oder eine Änderung der Insulinstärke kann dazu führen, dass die Dosierung geändert werden muss. Wie bei allen Insulinpräparaten kann der zeitliche Verlauf der NovoLog-Wirkung bei verschiedenen Personen oder zu verschiedenen Zeiten in derselben variieren individuell und hängt von vielen Bedingungen ab, einschließlich der Injektionsstelle, der örtlichen Blutversorgung, der Temperatur und der körperlichen Aktivität. Patienten, die ihre körperliche Aktivität oder ihren Ernährungsplan ändern, müssen möglicherweise die Insulindosierungen anpassen. Der Insulinbedarf kann sich während einer Krankheit, emotionalen Störungen oder anderen Belastungen ändern.
Patienten, die eine kontinuierliche subkutane Insulininfusionspumpentherapie anwenden, müssen für die Verabreichung von Insulin durch Injektion geschult sein und für den Fall eines Pumpenversagens über eine alternative Insulintherapie verfügen.
Hypoglykämie
Hypoglykämie ist die häufigste Nebenwirkung aller Insulintherapien, einschließlich NovoLog. Eine schwere Hypoglykämie kann zu Bewusstlosigkeit und / oder Krämpfen führen und zu einer vorübergehenden oder dauerhaften Beeinträchtigung der Gehirnfunktion oder zum Tod führen. Schwere Hypoglykämie, die die Unterstützung einer anderen Person und / oder eine parenterale Glukoseinfusion erfordert, oder Die Verabreichung von Glucagon wurde in klinischen Studien mit Insulin beobachtet, einschließlich Studien mit NovoLog.
Der Zeitpunkt der Hypoglykämie spiegelt normalerweise das Zeitwirkungsprofil der verabreichten Insulinformulierungen wider [siehe Klinische Pharmakologie]. Andere Faktoren wie Änderungen der Nahrungsaufnahme (z. B. Nahrungsmenge oder Zeitpunkt der Mahlzeiten), der Injektionsstelle, des Trainings und der gleichzeitigen Einnahme von Medikamenten können ebenfalls das Risiko einer Hypoglykämie verändern [siehe Wechselwirkungen mit anderen Medikamenten]. Wie bei allen Insulinen ist bei Patienten mit unbewusster Hypoglykämie und bei Patienten, die möglicherweise für Hypoglykämie prädisponiert sind (z. B. Patienten, die fasten oder unregelmäßig essen), Vorsicht geboten. Die Konzentrations- und Reaktionsfähigkeit des Patienten kann durch Hypoglykämie beeinträchtigt werden. Dies kann ein Risiko in Situationen darstellen, in denen diese Fähigkeiten besonders wichtig sind, z. B. beim Fahren oder Bedienen anderer Maschinen.
Schnelle Veränderungen des Serumglucosespiegels können bei Personen mit Diabetes unabhängig vom Glucosewert Symptome einer Hypoglykämie hervorrufen. Frühwarnsymptome einer Hypoglykämie können unter bestimmten Umständen unterschiedlich oder weniger ausgeprägt sein, wie z langjähriger Diabetes, diabetische Nervenkrankheit, Verwendung von Medikamenten wie Betablockern oder verstärktem Diabetes Kontrolle [siehe Wechselwirkungen mit anderen Medikamenten]. Diese Situationen können zu schwerer Hypoglykämie (und möglicherweise zu Bewusstlosigkeit) führen, bevor der Patient sich einer Hypoglykämie bewusst wird. Intravenös verabreichtes Insulin setzt schneller ein als subkutan verabreichtes Insulin und erfordert eine genauere Überwachung auf Hypoglykämie.
Hypokaliämie
Alle Insulinprodukte, einschließlich NovoLog, bewirken eine Verschiebung des Kaliums vom extrazellulären zum intrazellulären Raum. möglicherweise zu einer Hypokaliämie führen, die, wenn sie nicht behandelt wird, Atemlähmungen, ventrikuläre Arrhythmien und Tod. Seien Sie vorsichtig bei Patienten, bei denen möglicherweise ein Risiko für Hypokaliämie besteht (z. B. Patienten, die kaliumsenkende Medikamente einnehmen, Patienten Einnahme von Medikamenten, die empfindlich auf Serumkaliumkonzentrationen reagieren, und Patienten, die intravenös verabreicht werden Insulin).
Nierenfunktionsstörung
Wie bei anderen Insulinen kann der Dosisbedarf für NovoLog bei Patienten mit Nierenfunktionsstörung reduziert sein [siehe Klinische Pharmakologie].
Leberfunktionsstörung
Wie bei anderen Insulinen kann der Dosisbedarf für NovoLog bei Patienten mit Leberfunktionsstörung reduziert sein [siehe Klinische Pharmakologie].
Überempfindlichkeit und allergische Reaktionen
Lokale Reaktionen - Wie bei anderen Insulintherapien können bei Patienten an der Stelle der NovoLog-Injektion Rötungen, Schwellungen oder Juckreiz auftreten. Diese Reaktionen klingen normalerweise nach einigen Tagen bis zu einigen Wochen ab, können jedoch in einigen Fällen das Absetzen von NovoLog erforderlich machen. In einigen Fällen können diese Reaktionen mit anderen Faktoren als Insulin zusammenhängen, wie zum Beispiel Reizstoffen in einem Hautreinigungsmittel oder einer schlechten Injektionstechnik. Lokalisierte Reaktionen und generalisierte Myalgien wurden mit injiziertem Metacresol, einem Hilfsstoff in NovoLog, berichtet.
Systemische Reaktionen - Schwerwiegende, lebensbedrohliche, generalisierte Allergien, einschließlich Anaphylaxie, können bei allen Insulinprodukten, einschließlich NovoLog, auftreten. Anaphylaktische Reaktionen mit NovoLog wurden nach der Zulassung gemeldet. Eine generalisierte Allergie gegen Insulin kann auch Hautausschlag (einschließlich Juckreiz), Atemnot, Keuchen, Hypotonie, Tachykardie oder Diaphorese verursachen. In kontrollierten klinischen Studien wurden allergische Reaktionen bei 3 von 735 Patienten (0,4%) berichtet, die mit normalem Humaninsulin behandelt wurden, und bei 10 von 1394 Patienten (0,7%), die mit NovoLog behandelt wurden. In kontrollierten und unkontrollierten klinischen Studien brachen 3 von 2341 (0,1%) mit NovoLog behandelten Patienten die Behandlung wegen allergischer Reaktionen ab.
Antikörperproduktion
Bei mit NovoLog behandelten Patienten wurde ein Anstieg der Anti-Insulin-Antikörpertiter beobachtet, die sowohl mit Humaninsulin als auch mit Insulinaspart reagieren. Ein Anstieg der Anti-Insulin-Antikörper wird bei NovoLog häufiger beobachtet als bei normalem Humaninsulin. Daten aus einer 12-monatigen kontrollierten Studie bei Patienten mit Typ-1-Diabetes legen nahe, dass der Anstieg dieser Antikörper vorübergehend ist und die Unterschiede Die nach 3 und 6 Monaten beobachteten Antikörperspiegel zwischen den regulären Humaninsulin- und Insulinaspart-Behandlungsgruppen waren nach 12 Monaten nicht mehr sichtbar Monate. Die klinische Bedeutung dieser Antikörper ist nicht bekannt. Diese Antikörper scheinen keine Verschlechterung der Blutzuckerkontrolle zu verursachen oder eine Erhöhung der Insulindosis erforderlich zu machen.
Mischen von Insulinen
- Das Mischen von NovoLog mit NPH-Humaninsulin unmittelbar vor der Injektion verringert die Spitzenkonzentration von NovoLog, ohne die Zeit bis zur Spitzenkonzentration oder die gesamte Bioverfügbarkeit von NovoLog. Wenn NovoLog mit NPH-Humaninsulin gemischt wird, sollte NovoLog zuerst in die Spritze gezogen und die Mischung sofort nach dem Mischen injiziert werden.
- Die Wirksamkeit und Sicherheit des Mischens von NovoLog mit Insulinpräparaten anderer Hersteller wurde nicht untersucht.
- Insulinmischungen sollten nicht intravenös verabreicht werden.
Kontinuierliche subkutane Insulininfusion durch externe Pumpe
Bei Verwendung in einer externen subkutanen Insulininfusionspumpe darf NovoLog nicht mit anderen Insulinen oder Verdünnungsmitteln gemischt werden. Bei der Verwendung von NovoLog in einer externen Insulinpumpe sollten die NovoLog-spezifischen Informationen befolgt werden (z. B. Verwendungsdauer, Häufigkeit des Wechsels der Infusionssets), da die NovoLog-spezifischen Informationen vom allgemeinen Pumpenhandbuch abweichen können Anleitung.
Fehlfunktionen der Pumpe oder des Infusionssets oder der Insulinabbau können aufgrund des kleinen subkutanen Insulindepots zu einem raschen Auftreten von Hyperglykämie und Ketose führen. Dies gilt insbesondere für schnell wirkende Insulinanaloga, die schneller über die Haut aufgenommen werden und eine kürzere Wirkdauer haben. Eine rasche Identifizierung und Behebung der Ursache für Hyperglykämie oder Ketose ist erforderlich. Eine Zwischentherapie mit subkutaner Injektion kann erforderlich sein [siehe Dosierung und Anwendung, Warnungen und Vorsichtsmaßnahmen, und Lieferform / Lagerung und Handhabung].
NovoLog wird für die Verwendung in Pumpensystemen empfohlen, die für die unten aufgeführte Insulininfusion geeignet sind.
Pumps:
MiniMed 500-Serie und andere gleichwertige Pumpen.
Behälter und Infusionssets:
NovoLog wird für die Verwendung in Reservoir- und Infusionssets empfohlen, die mit Insulin und der spezifischen Pumpe kompatibel sind. In-vitro-Studien haben gezeigt, dass eine Fehlfunktion der Pumpe, ein Verlust von Metacresol und ein Insulinabbau auftreten können, wenn NovoLog länger als 48 Stunden in einem Pumpensystem aufbewahrt wird. Behälter und Infusionssets sollten mindestens alle 48 Stunden gewechselt werden.
NovoLog darf keinen Temperaturen über 37 ° C ausgesetzt werden. NovoLog, das in einer Pumpe verwendet wird, darf nicht mit anderem Insulin oder einem Verdünnungsmittel gemischt werden [siehe Dosierung und Anwendung, Warnungen und Vorsichtsmaßnahmen, und Lieferform / Lagerung und Handhabung].
oben
Nebenwirkungen
Erfahrung in klinischen Studien
Da klinische Studien in sehr unterschiedlichen Designs durchgeführt werden, ist es möglich, dass die in einer klinischen Studie angegebenen Nebenwirkungsraten nicht zutreffen leicht mit den in einer anderen klinischen Studie gemeldeten Raten verglichen werden können und möglicherweise nicht die tatsächlich in der klinischen Studie beobachteten Raten widerspiegeln trainieren.
- Hypoglykämie
Hypoglykämie ist die am häufigsten beobachtete Nebenwirkung bei Patienten, die Insulin verwenden, einschließlich NovoLog [siehe Warnungen und Vorsichtsmaßnahmen].
- Insulininitiierung und Intensivierung der Glukosekontrolle
Eine Intensivierung oder schnelle Verbesserung der Glukosekontrolle wurde mit einer vorübergehenden, reversiblen Verbindung in Verbindung gebracht ophthalmologische Refraktionsstörung, Verschlechterung der diabetischen Retinopathie und akute schmerzhafte periphere Neuropathie. Eine langfristige Blutzuckerkontrolle verringert jedoch das Risiko einer diabetischen Retinopathie und Neuropathie.
- Lipodystrophie
Die Langzeitanwendung von Insulin, einschließlich NovoLog, kann zu Lipodystrophie an der Stelle von wiederholten Insulininjektionen oder Infusionen führen. Die Lipodystrophie umfasst die Lipohypertrophie (Verdickung des Fettgewebes) und die Lipoatrophie (Verdünnung des Fettgewebes) und kann die Insulinabsorption beeinflussen. Drehen Sie die Insulininjektions- oder Infusionsstellen innerhalb derselben Region, um das Risiko einer Lipodystrophie zu verringern.
- Gewichtszunahme
Bei einigen Insulintherapien, einschließlich NovoLog, kann es zu einer Gewichtszunahme kommen, die auf die anabolen Wirkungen von Insulin und die Abnahme der Glucosurie zurückzuführen ist.
- Periphere Ödeme
Insulin kann Natriumretention und Ödeme verursachen, insbesondere wenn zuvor eine schlechte Stoffwechselkontrolle durch eine intensivierte Insulintherapie verbessert wird.
- Häufigkeit unerwünschter Arzneimittelwirkungen
Die Häufigkeit unerwünschter Arzneimittelwirkungen während klinischer Studien mit NovoLog bei Patienten mit Typ-1-Diabetes mellitus und Typ-2-Diabetes mellitus ist in den folgenden Tabellen aufgeführt.
Tabelle 1: Behandlungsbedingte unerwünschte Ereignisse bei Patienten mit Typ-1-Diabetes mellitus (unerwünschte Ereignisse) mit einer Häufigkeit von 5% und häufiger mit NovoLog im Vergleich zu normalem Humaninsulin gelistet)
|
NovoLog + NPH N = 596 |
Humanes reguläres Insulin + NPH N = 286 |
|||
| Bevorzugter Begriff | N | (%) | N | (%) |
| Hypoglykämie * | 448 | 75% | 205 | 72% |
| Kopfschmerzen | 70 | 12% | 28 | 10% |
| Verletzung versehentlich | 65 | 11% | 29 | 10% |
| Übelkeit | 43 | 7% | 13 | 5% |
| Durchfall | 28 | 5% | 9 | 3% |
* Hypoglykämie ist definiert als eine Episode der Blutzuckerkonzentration
Tabelle 2: Behandlungsbedingte unerwünschte Ereignisse bei Patienten mit Typ-2-Diabetes mellitus (außer Hypoglykämie) unerwünschte Ereignisse mit einer Häufigkeit von 5% und häufiger mit NovoLog im Vergleich zu normalem Humaninsulin gelistet)
|
NovoLog + NPH N = 91 |
Humanes reguläres Insulin + NPH N = 91 |
|||
| N | (%) | N | (%) | |
| Hypoglykämie * | 25 | 27% | 33 | 36% |
| Hyporeflexie | 10 | 11% | 6 | 7% |
| Onychomykose | 9 | 10% | 5 | 5% |
| Sensorische Störung | 8 | 9% | 6 | 7% |
| Infektion der Harnwege | 7 | 8% | 6 | 7% |
| Brustschmerz | 5 | 5% | 3 | 3% |
| Kopfschmerzen | 5 | 5% | 3 | 3% |
| Hautkrankheit | 5 | 5% | 2 | 2% |
| Bauchschmerzen | 5 | 5% | 1 | 1% |
| Sinusitis | 5 | 5% | 1 | 1% |
* Hypoglykämie ist definiert als eine Episode der Blutzuckerkonzentration
Postmarketing-Daten
Die folgenden zusätzlichen Nebenwirkungen wurden während der Anwendung von NovoLog nach der Zulassung festgestellt. Da diese Nebenwirkungen freiwillig von einer Population ungewisser Größe gemeldet werden, ist es im Allgemeinen nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen. Bei der Anwendung nach der Zulassung wurden Medikationsfehler festgestellt, bei denen NovoLog versehentlich durch andere Insuline ersetzt wurde.
oben
Wechselwirkungen mit anderen Medikamenten
Eine Reihe von Substanzen beeinflussen den Glukosestoffwechsel und erfordern möglicherweise eine Anpassung der Insulindosis und eine besonders genaue Überwachung.
- Das Folgende sind Beispiele für Substanzen, die die blutzuckersenkende Wirkung und die Anfälligkeit für Hypoglykämie erhöhen können: orale Antidiabetika, Pramlintid, ACE Inhibitoren, Disopyramid, Fibrate, Fluoxetin, Monoaminoxidase (MAO) -Inhibitoren, Propoxyphen, Salicylate, Somatostatinanalogon (z. B. Octreotid), Sulfonamid Antibiotika.
- Das Folgende sind Beispiele für Substanzen, die die blutzuckersenkende Wirkung verringern können: Corticosteroide, Niacin, Danazol, Diuretika, Sympathomimetika (z. Adrenalin, Salbutamol, Terbutalin), Isoniazid, Phenothiazinderivate, Somatropin, Schilddrüsenhormone, Östrogene, Gestagene (z. B. in oralen Kontrazeptiva), atypisch Antipsychotika.
- Betablocker, Clonidin, Lithiumsalze und Alkohol können die blutzuckersenkende Wirkung von Insulin entweder potenzieren oder schwächen.
- Pentamidin kann eine Hypoglykämie verursachen, auf die manchmal eine Hyperglykämie folgt.
- Die Anzeichen einer Hypoglykämie können bei Patienten, die sympatholytische Produkte wie Betablocker, Clonidin, Guanethidin und Reserpin einnehmen, verringert sein oder fehlen.
oben
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaftskategorie B. Alle Schwangerschaften haben unabhängig von der Arzneimittelexposition ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. Dieses Hintergrundrisiko ist bei durch Hyperglykämie komplizierten Schwangerschaften erhöht und kann bei guter Stoffwechselkontrolle verringert werden. Für Patienten mit Diabetes oder Schwangerschaftsdiabetes in der Vorgeschichte ist es wichtig, vor der Empfängnis und während der Schwangerschaft eine gute Stoffwechselkontrolle aufrechtzuerhalten. Der Insulinbedarf kann während des ersten Trimesters abnehmen, im Allgemeinen während des zweiten und dritten Trimesters zunehmen und nach der Entbindung rasch abnehmen. Bei diesen Patienten ist eine sorgfältige Überwachung der Glukosekontrolle unerlässlich. Daher sollte weiblichen Patienten geraten werden, ihrem Arzt mitzuteilen, ob sie beabsichtigen, schwanger zu werden, oder ob sie während der Einnahme von NovoLog schwanger werden.
Eine offene, randomisierte Studie verglich die Sicherheit und Wirksamkeit von NovoLog (n = 157) mit normalem Humaninsulin (n = 165) bei 322 schwangeren Frauen mit Typ-1-Diabetes. Zwei Drittel der eingeschlossenen Patienten waren bereits schwanger, als sie in die Studie eintraten. Da nur ein Drittel der Patienten vor der Empfängnis aufgenommen wurde, war die Studie nicht groß genug, um das Risiko angeborener Missbildungen zu bewerten. Beide Gruppen erreichten während der Schwangerschaft einen mittleren HbA1c-Wert von ~ 6%, und es gab keinen signifikanten Unterschied in der Inzidenz mütterlicher Hypoglykämie.
Subkutane Reproduktions- und Teratologiestudien wurden mit NovoLog und regulärem Humaninsulin bei Ratten und Kaninchen durchgeführt. In diesen Studien wurde NovoLog weiblichen Ratten vor der Paarung, während der Paarung und während der Schwangerschaft sowie Kaninchen während der Organogenese verabreicht. Die Wirkungen von NovoLog unterschieden sich nicht von denen, die mit subkutanem normalem Humaninsulin beobachtet wurden. NovoLog verursachte wie Humaninsulin bei Ratten bei einer Dosis von 200 U / kg / Tag (ungefähr das 32-fache des menschlichen Subkutans) Verluste vor und nach der Implantation sowie viszerale / skelettale Anomalien Dosis von 1,0 U / kg / Tag, bezogen auf U / Körperoberfläche) und bei Kaninchen in einer Dosis von 10 U / kg / Tag (ungefähr das Dreifache der subkutanen Dosis des Menschen von 1,0 U / kg / Tag, bezogen auf U /). Körperoberfläche Bereich). Die Auswirkungen sind wahrscheinlich sekundär zur mütterlichen Hypoglykämie bei hohen Dosen. Bei Ratten mit einer Dosis von 50 U / kg / Tag und bei Kaninchen mit einer Dosis von 3 U / kg / Tag wurden keine signifikanten Effekte beobachtet. Diese Dosen betragen ungefähr das 8-fache der menschlichen subkutanen Dosis von 1,0 U / kg / Tag für Ratten und entsprechen der menschlichen subkutanen Dosis von 1,0 U / kg / Tag für Kaninchen, bezogen auf die U / Körperoberfläche.
Stillende Mutter
Es ist nicht bekannt, ob Insulinaspart in die Muttermilch übergeht. Die Anwendung von NovoLog ist mit dem Stillen vereinbar, aber Frauen mit Diabetes, die stillen, müssen möglicherweise ihre Insulindosen anpassen.
Pädiatrische Verwendung
NovoLog ist für die Anwendung bei Kindern zur subkutanen täglichen Injektion und zur subkutanen kontinuierlichen Infusion mit einer externen Insulinpumpe zugelassen. Bitte siehe Abschnitt KLINISCHE STUDIEN für Zusammenfassungen von klinischen Studien.
Geriatrische Verwendung
Von der Gesamtzahl der in 3 kontrollierten klinischen Studien mit NovoLog behandelten Patienten (n = 1.375) waren 2,6% (n = 36) 65 Jahre oder älter. Eine Hälfte dieser Patienten hatte Typ-1-Diabetes (18/1285) und die andere Hälfte hatte Typ-2-Diabetes (18/90). Die HbA1c-Reaktion auf NovoLog unterschied sich im Vergleich zu Humaninsulin nicht nach Alter, insbesondere bei Patienten mit Typ-2-Diabetes. Zusätzliche Studien an größeren Populationen von Patienten ab 65 Jahren sind erforderlich, um Rückschlüsse auf die Sicherheit von NovoLog bei älteren Patienten im Vergleich zu jüngeren Patienten zu ziehen. Pharmakokinetische / pharmakodynamische Studien zur Beurteilung des Einflusses des Alters auf den Beginn der NovoLog-Wirkung wurden nicht durchgeführt.
oben
Überdosierung
Eine übermäßige Insulinverabreichung kann zu Hypoglykämie und insbesondere bei intravenöser Gabe zu Hypokaliämie führen. Leichte Hypoglykämien können normalerweise mit oraler Glukose behandelt werden. Möglicherweise sind Anpassungen der Medikamentendosis, der Ernährungsgewohnheiten oder des Trainings erforderlich. Schwerwiegendere Episoden mit Koma, Anfall oder neurologischer Beeinträchtigung können mit intramuskulärem / subkutanem Glukagon oder konzentrierter intravenöser Glukose behandelt werden. Eine anhaltende Kohlenhydrataufnahme und -beobachtung kann erforderlich sein, da eine Hypoglykämie nach einer offensichtlichen klinischen Erholung erneut auftreten kann. Hypokaliämie muss entsprechend korrigiert werden.
oben
Beschreibung
NovoLog (Insulin-Aspart [rDNA Origin] -Injektion) ist ein schnell wirkendes Humaninsulinanalog zur Senkung des Blutzuckers. NovoLog ist mit Ausnahme einer einzigen Substitution der Aminosäure Prolin durch homolog zu normalem Humaninsulin Asparaginsäure in Position B28 und wird durch rekombinante DNA - Technologie unter Verwendung von Saccharomyces cerevisiae (Bäcker) hergestellt Hefe). Insulinaspart hat die Summenformel C256H.381N65079S6 und ein Molekulargewicht von 5825,8.
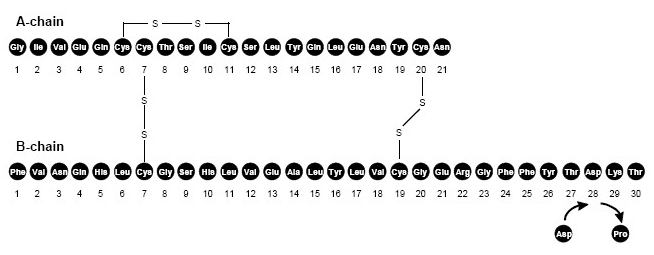
Abbildung 1. Strukturformel von Insulin Aspart.
NovoLog ist eine sterile, wässrige, klare und farblose Lösung, die Insulin Aspart 100 Einheiten / ml, Glycerin 16 mg / ml, Phenol enthält 1,50 mg / ml, Metacresol 1,72 mg / ml, Zink 19,6 ug / ml, Dinatriumhydrogenphosphatdihydrat 1,25 mg / ml und Natriumchlorid 0,58 mg / ml. NovoLog hat einen pH-Wert von 7,2-7,6. Zur Einstellung des pH-Werts können 10% ige Salzsäure und / oder 10% ige Natriumhydroxidlösung zugesetzt werden.
oben
Klinische Pharmakologie
Wirkmechanismus
Die Hauptaktivität von NovoLog ist die Regulierung des Glukosestoffwechsels. Insuline, einschließlich NovoLog, binden an die Insulinrezeptoren von Muskel- und Fettzellen und senken den Blutzucker durch Erleichterung der zellulären Aufnahme von Glukose und gleichzeitige Hemmung der Glukoseabgabe aus dem Leber.
Pharmakodynamik
Studien an normalen Freiwilligen und Patienten mit Diabetes zeigten, dass die subkutane Verabreichung von NovoLog einen schnelleren Wirkungseintritt hat als normales Humaninsulin.
In einer Studie bei Patienten mit Typ-1-Diabetes (n = 22) trat die maximale glukoseabsenkende Wirkung von NovoLog zwischen 1 und 3 Stunden nach subkutaner Injektion auf (siehe Abbildung 2). Die Wirkdauer für NovoLog beträgt 3 bis 5 Stunden. Der zeitliche Ablauf der Wirkung von Insulin und Insulinanaloga wie NovoLog kann bei verschiedenen Personen oder innerhalb derselben Person erheblich variieren. Die in Abbildung 2 angegebenen Parameter der NovoLog-Aktivität (Beginn, Spitzenzeit und Dauer) sind nur als allgemeine Richtlinien zu verstehen. Die Geschwindigkeit der Insulinabsorption und des Aktivitätsbeginns wird durch den Ort der Injektion, das Training und andere Variablen beeinflusst [siehe Warnungen und Vorsichtsmaßnahmen].
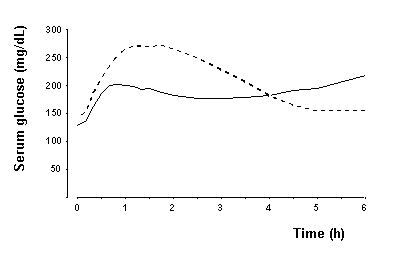
Figur 2. Serielle mittlere Serumglukose, die bis zu 6 Stunden nach einmaliger Gabe von NovoLog vor der Mahlzeit gesammelt wurde (durchgezogene Kurve) oder normales Humaninsulin (schraffierte Kurve), das 22 Patienten mit Typ 1 unmittelbar vor einer Mahlzeit injiziert wurde Diabetes.
Eine doppelblinde, randomisierte Zwei-Wege-Cross-Over-Studie bei 16 Patienten mit Typ-1-Diabetes zeigte, dass intravenös Die Infusion von NovoLog führte zu einem Blutzuckerprofil, das dem nach intravenöser Infusion mit normalem Menschen ähnelte Insulin. NovoLog oder Humaninsulin wurde infundiert, bis der Blutzucker des Patienten auf 36 mg / dl abnahm oder bis der Patient infundierte Anzeichen einer Hypoglykämie (Anstieg der Herzfrequenz und Beginn des Schwitzens), definiert als die Zeit der autonomen Reaktion (R) (siehe Abbildung 3).
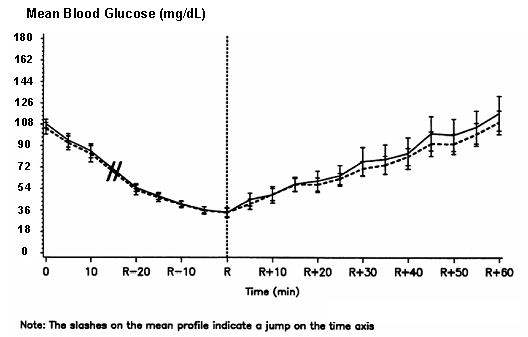
Figur 3. Serielle mittlere Serumglukose nach intravenöser Infusion von NovoLog (schraffierte Kurve) und normalem Humaninsulin (durchgezogene Kurve) bei 16 Patienten mit Typ-1-Diabetes. R steht für die Zeit der autonomen Reaktion.
Pharmakokinetik
Die einfache Substitution der Aminosäure Prolin durch Asparaginsäure an Position B28 in NovoLog verringert die Tendenz des Moleküls zur Bildung von Hexameren, wie sie bei normalem Humaninsulin beobachtet wird. NovoLog wird daher nach subkutaner Injektion schneller resorbiert als normales Humaninsulin.
In einer randomisierten, doppelblinden Crossover-Studie wurden 17 gesunde kaukasische männliche Probanden zwischen 18 und 40 Jahren untersucht Alter erhielt eine intravenöse Infusion von entweder NovoLog oder normalem Humaninsulin mit 1,5 mU / kg / min für 120 Protokoll. Die mittlere Insulinclearance war für die beiden Gruppen mit Mittelwerten von 1,2 l / h / kg für die NovoLog-Gruppe und 1,2 l / h / kg für die normale Humaninsulingruppe ähnlich.
Bioverfügbarkeit und Resorption - NovoLog hat eine schnellere Resorption, einen schnelleren Wirkungseintritt und a kürzere Wirkdauer als normales Humaninsulin nach subkutaner Injektion (siehe Abbildung 2 und 3) Figur 4). Die relative Bioverfügbarkeit von NovoLog im Vergleich zu normalem Humaninsulin weist darauf hin, dass die beiden Insuline in ähnlichem Maße resorbiert werden.

Figur 4. Serielle mittlere serumfreie Insulinkonzentration, die bis zu 6 Stunden nach einer einzelnen Dosis NovoLog vor der Mahlzeit gesammelt wurde (durchgezogene Kurve) oder normales Humaninsulin (schraffierte Kurve), das unmittelbar vor einer Mahlzeit bei 22 Patienten mit Typ 1 injiziert wurde Diabetes.
In Studien an gesunden Freiwilligen (insgesamt n = 107) und Patienten mit Typ-1-Diabetes (insgesamt n = 40) NovoLog erreichte durchweg ungefähr doppelt so schnell Spitzenkonzentrationen im Serum wie der normale Mensch Insulin. Die mittlere Zeit bis zur maximalen Konzentration in diesen Studien betrug 40 bis 50 Minuten für NovoLog gegenüber 80 bis 120 Minuten für normales Humaninsulin. In einer klinischen Studie bei Patienten mit Typ-1-Diabetes wurden NovoLog und reguläres Humaninsulin verabreicht subkutan bei einer Dosis von 0,15 E / kg Körpergewicht mittlere Höchstkonzentrationen von 82 und 36 mU / l erreicht, beziehungsweise. Bei Patienten mit Typ-2-Diabetes wurden keine pharmakokinetischen / pharmakodynamischen Eigenschaften von Insulinaspart nachgewiesen.
Die intraindividuelle zeitliche Variabilität bis zur maximalen Seruminsulinkonzentration war bei gesunden männlichen Probanden bei NovoLog signifikant geringer als bei normalem Humaninsulin. Die klinische Bedeutung dieser Beobachtung wurde nicht nachgewiesen.
In einer klinischen Studie an gesunden, nicht adipösen Probanden wurden die pharmakokinetischen Unterschiede zwischen NovoLog und Regular untersucht Das oben beschriebene Humaninsulin wurde unabhängig von der Injektionsstelle (Bauch, Oberschenkel oder Oberkörper) beobachtet Arm).
Verteilung und Elimination - NovoLog hat eine geringe Bindung an Plasmaproteine (<10%), ähnlich wie bei normalem Humaninsulin. Nach subkutaner Verabreichung bei normalen männlichen Probanden (n = 24) wurde NovoLog schneller eliminiert als normales Humaninsulin mit einer durchschnittlichen scheinbaren Halbwertszeit von 81 Minuten im Vergleich zu 141 Minuten beim normalen Menschen Insulin.
Spezifische Populationen
Kinder und Jugendliche - Die pharmakokinetischen und pharmakodynamischen Eigenschaften von NovoLog und normalem Humaninsulin wurden bewertet in einer Einzeldosisstudie an 18 Kindern (6-12 Jahre, n = 9) und Jugendlichen (13-17 Jahre [Tanner-Grad> 2], n = 9) mit Typ 1 Diabetes. Die relativen Unterschiede in der Pharmakokinetik und Pharmakodynamik bei Kindern und Jugendlichen mit Typ-1-Diabetes Der Unterschied zwischen NovoLog und normalem Humaninsulin war ähnlich wie bei gesunden erwachsenen Probanden und Erwachsenen mit Typ 1 Diabetes.
Geschlecht - Bei gesunden Probanden wurde unter Berücksichtigung der Körpergewichtsunterschiede kein Unterschied im Insulin-Aspart-Spiegel zwischen Männern und Frauen festgestellt. In einer Studie mit Patienten mit Typ-1-Diabetes wurde kein signifikanter Unterschied in der Wirksamkeit zwischen den Geschlechtern festgestellt (wie durch HbAlc bewertet).
Fettleibigkeit - Eine einzelne subkutane Dosis von 0,1 E / kg NovoLog wurde in einer Studie mit 23 Patienten mit Typ-1-Diabetes und einem breiten Bereich von Body-Mass-Index (BMI, 22-39 kg / m2) verabreicht. Die pharmakokinetischen Parameter AUC und Cmax von NovoLog wurden im Allgemeinen von BMI in den verschiedenen Gruppen nicht beeinflusst - BMI 19-23 kg / m2 (N = 4); BMI 23-27 kg / m² (N = 7); BMI 27-32 kg / m² (N = 6) und BMI> 32 kg / m² (N = 6). Die Clearance von NovoLog war bei Patienten mit einem BMI> 32 kg / m2 um 28% niedriger als bei Patienten mit einem BMI
Niereninsuffizienz - Einige Studien mit Humaninsulin haben bei Patienten mit Nierenversagen einen erhöhten Insulinspiegel im Blut gezeigt. Eine einzelne subkutane Dosis von 0,08 E / kg NovoLog wurde in einer Studie an Probanden mit einer normalen (N = 6) Kreatinin-Clearance (CLcr) (> 80 ml / min) oder einer milden (N = 7; CLcr = 50-80 ml / min), mäßig (N = 3; CLcr = 30-50 ml / min) oder schwer (aber keine Hämodialyse erforderlich) (N = 2; CLcr = Warnungen und Vorsichtsmaßnahmen].
Leberfunktionsstörung - Einige Studien mit Humaninsulin haben bei Patienten mit Leberversagen einen erhöhten Insulinspiegel im Blutkreislauf gezeigt. Eine subkutane Einzeldosis von 0,06 U / kg NovoLog wurde in einer offenen Einzeldosisstudie an 24 Probanden (N = 6 / Gruppe) mit unterschiedlichen Probanden verabreicht Grad der Leberfunktionsstörung (leicht, mittelschwer und schwer) mit Child-Pugh-Werten zwischen 0 (gesunde Freiwillige) und 12 (schwere Leber) Beeinträchtigung). In dieser kleinen Studie gab es keine Korrelation zwischen dem Grad des Leberversagens und einem pharmakokinetischen Parameter von NovoLog. Bei Patienten mit Leberfunktionsstörung kann eine sorgfältige Glukoseüberwachung und Dosisanpassung von Insulin, einschließlich NovoLog, erforderlich sein [siehe Warnungen und Vorsichtsmaßnahmen].
Der Einfluss von Alter, ethnischer Herkunft, Schwangerschaft und Rauchen auf die Pharmakokinetik und Pharmakodynamik von NovoLog wurde nicht untersucht.
oben
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Standardstudien zur Kanzerogenität über 2 Jahre bei Tieren wurden nicht durchgeführt, um das kanzerogene Potenzial von NovoLog zu bewerten. In 52-wöchigen Studien wurde Sprague-Dawley-Ratten NovoLog subkutan mit 10, 50 und 200 E / kg / Tag verabreicht (ungefähr das 2-, 8- und 32-fache der menschlichen subkutanen Dosis von 1,0 U / kg / Tag, bezogen auf die U / Körperoberfläche) beziehungsweise). Bei einer Dosis von 200 U / kg / Tag erhöhte NovoLog die Inzidenz von Brustdrüsentumoren bei Frauen im Vergleich zu unbehandelten Kontrollen. Die Inzidenz von Brusttumoren war bei NovoLog nicht signifikant anders als bei normalem Humaninsulin. Die Relevanz dieser Befunde für den Menschen ist nicht bekannt. NovoLog war in den folgenden Tests nicht genotoxisch: Ames-Test, Maus-Lymphomzell-Forward-Genmutationstest, humane Peripherie Blut-Lymphozyten-Chromosomenaberrationstest, In-vivo-Mikronukleustest an Mäusen und Ex-vivo-UDS-Test an Rattenleber Hepatozyten. In Fertilitätsstudien an männlichen und weiblichen Ratten bei subkutanen Dosen bis zu 200 U / kg / Tag (ungefähr das 32-fache der subkutanen Dosis beim Menschen) basierend auf der U / Körperoberfläche) gab es keine direkten nachteiligen Auswirkungen auf die männliche und weibliche Fruchtbarkeit oder die allgemeine Reproduktionsleistung von Tieren beobachteten.
Tier-Toxikologie und / oder Pharmakologie
In biologischen Standardtests bei Mäusen und Kaninchen hat eine Einheit NovoLog die gleiche glukosesenkende Wirkung wie eine Einheit normales Humaninsulin. Beim Menschen setzt die Wirkung von NovoLog aufgrund seiner schnelleren Resorption nach subkutaner Injektion schneller ein und dauert kürzer als bei normalem Humaninsulin (siehe Abschnitt KLINISCHE PHARMAKOLOGIE Abbildung 2 und Abbildung 4).
oben
Klinische Studien
Tägliche subkutane Injektionen
Zwei sechsmonatige, offene, aktiv kontrollierte Studien wurden durchgeführt, um die Sicherheit und Wirksamkeit von NovoLog mit Novolin R bei erwachsenen Patienten mit Typ-1-Diabetes zu vergleichen. Da die beiden Studiendesigns und -ergebnisse ähnlich waren, werden Daten nur für eine Studie angezeigt (siehe Tabelle 3). NovoLog wurde unmittelbar vor den Mahlzeiten durch subkutane Injektion verabreicht, und normales Humaninsulin wurde 30 Minuten vor den Mahlzeiten durch subkutane Injektion verabreicht. NPH-Insulin wurde als Basalinsulin entweder in Einzeldosen oder in geteilten Tagesdosen verabreicht. Veränderungen des HbA1c und der Inzidenz von schwerer Hypoglykämie (bestimmt aus der Anzahl der Ereignisse, bei denen ein dritter eingreifen muss) waren für die beiden Behandlungsschemata in dieser Studie (Tabelle 3) sowie in den anderen in dieser Studie genannten klinischen Studien vergleichbar Sektion. In keiner der Studien mit Erwachsenen wurde über diabetische Ketoazidose berichtet.
Tisch 3. Subkutane NovoLog-Verabreichung bei Typ-1-Diabetes (24 Wochen; n = 882)
| NovoLog + NPH | Novolin R + NPH | |
| N | 596 | 286 |
| Baseline HbA1c (%)* | 7.9 ±1.1 | 8.0 ± 1.2 |
| Wechsel von der Basislinie HbA1c (%) | -0.1 ± 0.8 | 0.0 ± 0.8 |
| Behandlungsunterschied in HbA1c, Mittelwert (95% Konfidenzintervall) | -0.2 (-0.3, -0.1) | |
| Insulindosis zu Studienbeginn (IE / kg / 24 Stunden) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Insulindosis bei Studienende (IE / kg / 24 Stunden) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Patienten mit schwerer Hypoglykämie (n,%) â | 104 (17%) | 54 (19%) |
|
Grundkörpergewicht (kg) * Gewichtsänderung gegenüber dem Ausgangswert (kg) * |
75.3 ± 14.5 0.5 ± 3.3 |
75.9 ± 13.1 0.9 ± 2.9 |
* Die Werte sind Mittelwerte ± SD
â € žSchwere Hypoglykämie bezieht sich auf Hypoglykämie, die mit Symptomen des Zentralnervensystems verbunden ist und das Eingreifen einer anderen Person oder den Krankenhausaufenthalt erfordert.
Eine 24-wöchige Parallelgruppenstudie an Kindern und Jugendlichen mit Typ-1-Diabetes (n = 283) im Alter von 6 bis 18 Jahren Jahre verglichen zwei subkutane Mehrfachdosis-Behandlungsschemata: NovoLog (n = 187) oder Novolin R (n =) 96). NPH-Insulin wurde als Basalinsulin verabreicht. NovoLog erreichte eine mit Novolin R vergleichbare Blutzuckerkontrolle, gemessen durch Veränderung von HbA1c (Tabelle 4), und beide Behandlungsgruppen hatten eine vergleichbare Inzidenz von Hypoglykämie. Die subkutane Verabreichung von NovoLog und normalem Humaninsulin wurde auch bei Kindern mit Typ-1-Diabetes (n = 26) im Alter von 2 bis 6 Jahren mit ähnlichen Auswirkungen auf HbA1c und Hypoglykämie verglichen.
Tabelle 4. Pädiatrische subkutane Verabreichung von NovoLog bei Typ-1-Diabetes (24 Wochen; n = 283)
| NovoLog + NPH | Novolin R + NPH | |
| N | 187 | 96 |
| Baseline HbA1c (%) * | 8.3 ± 1.2 | 8.3 ± 1.3 |
| Wechsel von der Basislinie HbA1c (%) | 0.1 ± 1.0 | 0.1 ± 1.1 |
| Behandlungsunterschied in HbA1c, Mittelwert (95% Konfidenzintervall) | 0.1 (-0.5, 0.1) | |
| Insulindosis zu Studienbeginn (IE / kg / 24 Stunden) * | 0.4 ± 0.2 | 0.6 ± 0.2 |
| Insulindosis bei Studienende (IE / kg / 24 Stunden) * | 0.4 ± 0.2 | 0.7 ± 0.2 |
| Patienten mit schwerer Hypoglykämie (n,%) â | 11 (6%) | 9 (9%) |
| Diabetische Ketoazidose (n,%) | 10 (5%) | 2 (2%) |
|
Grundkörpergewicht (kg) * Gewichtsänderung gegenüber dem Ausgangswert (kg) * |
50.6 ± 19.6 2.7 ± 3.5 |
48.7 ± 15.8 2.4 ± 2.6 |
* Die Werte sind Mittelwerte ± SD
â € žSchwere Hypoglykämie bezieht sich auf Hypoglykämie, die mit Symptomen des Zentralnervensystems verbunden ist und das Eingreifen einer anderen Person oder den Krankenhausaufenthalt erfordert.
Eine sechsmonatige, offene, aktiv kontrollierte Studie wurde durchgeführt, um die Sicherheit und Wirksamkeit von NovoLog mit Novolin R bei Patienten mit Typ-2-Diabetes zu vergleichen (Tabelle 5). NovoLog wurde unmittelbar vor den Mahlzeiten durch subkutane Injektion verabreicht, und normales Humaninsulin wurde 30 Minuten vor den Mahlzeiten durch subkutane Injektion verabreicht. NPH-Insulin wurde als Basalinsulin entweder in Einzeldosen oder in geteilten Tagesdosen verabreicht. Die Veränderungen von HbAlc und die Rate schwerer Hypoglykämien (bestimmt aus der Anzahl der Ereignisse, die eine Intervention durch Dritte erfordern) waren für die beiden Behandlungsschemata vergleichbar.
Tabelle 5. Subkutane NovoLog-Verabreichung bei Typ-2-Diabetes (6 Monate; n = 176)
| NovoLog + NPH | Novolin R + NPH | |
| N | 90 | 86 |
| Baseline HbA1c (%) * | 8.1 ± 1.2 | 7.8 ± 1.1 |
| Wechsel von der Basislinie HbA1c (%) | -0.3 ± 1.0 | -0.1 ± 0.8 |
| Behandlungsunterschied in HbA1c, Mittelwert (95% Konfidenzintervall) | - 0.1 (-0.4, -0.1) | |
| Insulindosis zu Studienbeginn (IE / kg / 24 Stunden) * | 0.6 ± 0.3 | 0.6 ± 0.3 |
| Insulindosis bei Studienende (IE / kg / 24 Stunden) * | 0.7 ± 0.3 | 0.7 ± 0.3 |
| Patienten mit schwerer Hypoglykämie (n,%) | 9 (10%) | 5 (8%) |
|
Grundkörpergewicht (kg) * Gewichtsänderung gegenüber dem Ausgangswert (kg) * |
88.4 ± 13.3 1.2 ± 3.0 |
85.8 ± 14.8 0.4 ± 3.1 |
* Die Werte sind Mittelwerte ± SD
â € žSchwere Hypoglykämie bezieht sich auf Hypoglykämie, die mit Symptomen des Zentralnervensystems verbunden ist und das Eingreifen einer anderen Person oder den Krankenhausaufenthalt erfordert.
Kontinuierliche subkutane Insulininfusion (CSII) durch externe Pumpe
In zwei offenen, parallelen Designstudien (6 Wochen [n = 29] und 16 Wochen [n = 118]) wurde NovoLog mit gepuffertem regulär verglichen Humaninsulin (Velosulin) bei Erwachsenen mit Typ-1-Diabetes, die eine subkutane Infusion mit einem externen Insulin erhalten Pumpe. Die beiden Behandlungsschemata hatten vergleichbare Veränderungen von HbA1c und Raten schwerer Hypoglykämie.
Tabelle 6. Insulinpumpenstudie für Erwachsene bei Typ-1-Diabetes (16 Wochen; n = 118)
| NovoLog | Gepuffertes Humaninsulin | |
| N | 59 | 59 |
| Baseline HbA1c (%) * | 7.3 ± 0.7 | 7.5 ± 0.8 |
| Wechsel von der Basislinie HbA1c (%) | 0.0 ± 0.5 | 0.2 ± 0.6 |
| Behandlungsunterschied in HbA1c, Mittelwert (95% Konfidenzintervall) | 0.3 (-0.1, 0.4) | |
| Insulindosis zu Studienbeginn (IE / kg / 24 Stunden) * | 0.7 ± 0.8 | 0.6 ± 0.2 |
| Insulindosis bei Studienende (IE / kg / 24 Stunden) * | 0.7 ± 0.7 | 0.6 ± 0.2 |
| Patienten mit schwerer Hypoglykämie (n,%) | 1 (2%) | 2 (3%) |
|
Grundkörpergewicht (kg) * Gewichtsänderung gegenüber dem Ausgangswert (kg) * |
77.4 ± 16.1 0.1 ± 3.5 |
74.8 ± 13.8 -0.0 ± 1.7 |
* Die Werte sind Mittelwerte ± SD
â € žSchwere Hypoglykämie bezieht sich auf Hypoglykämie, die mit Symptomen des Zentralnervensystems verbunden ist und das Eingreifen einer anderen Person oder den Krankenhausaufenthalt erfordert.
Eine randomisierte, 16-wöchige, offene, parallele Designstudie an Kindern und Jugendlichen mit Typ-1-Diabetes (n = 298) im Alter von 4 bis 18 Jahren Jahre verglichen zwei subkutane Infusionsschemata, die über eine externe Insulinpumpe verabreicht wurden: NovoLog (n = 198) oder Insulin lispro (n = 100). Diese beiden Behandlungen führten nach 16-wöchiger Behandlung zu vergleichbaren Veränderungen gegenüber dem Ausgangswert von HbA1c und vergleichbaren Hypoglykämieraten (siehe Tabelle 7).
Tabelle 7. Pädiatrische Insulinpumpenstudie bei Typ-1-Diabetes (16 Wochen; n = 298)
| NovoLog | Lispro | |
| N | 198 | 100 |
| Baseline HbA1c (%) * | 8.0 ± 0.9 | 8.2 ± 0.8 |
| Wechsel von der Basislinie HbA1c (%) | -0.1 ± 0.8 | -0.1 ± 0.7 |
| Behandlungsunterschied in HbA1c, Mittelwert (95% Konfidenzintervall) | -0.1 (-0.3, 0.1) | |
| Insulindosis zu Studienbeginn (IE / kg / 24 Stunden) * | 0.9 ± 0.3 | 0.9 ± 0.3 |
| Insulindosis bei Studienende (IE / kg / 24 Stunden) * | 0.9 ± 0.2 | 0.9 ± 0.2 |
| Patienten mit schwerer Hypoglykämie (n,%) | 19 (10%) | 8 (8%) |
| Diabetische Ketoazidose (n,%) | 1 (0.5%) | 0 (0) |
|
Grundkörpergewicht (kg) * Gewichtsänderung gegenüber dem Ausgangswert (kg) * |
54.1 ± 19.7 1.8 ± 2.1 |
55.5 ± 19.0 1.6 ± 2.1 |
* Die Werte sind Mittelwerte ± SD
â € žSchwere Hypoglykämie bezieht sich auf Hypoglykämie, die mit Symptomen des Zentralnervensystems verbunden ist und das Eingreifen einer anderen Person oder den Krankenhausaufenthalt erfordert.
Eine offene, 16-wöchige parallele Designstudie verglich die vorprandiale NovoLog-Injektion mit NPH-Injektionen in NovoLog durch kontinuierliche subkutane Infusion bei 127 Erwachsenen mit Typ 2 Diabetes. Die beiden Behandlungsgruppen zeigten ähnliche HbA1c-Reduktionen und Raten schwerer Hypoglykämie (Tabelle 8) [siehe Indikationen und Verwendung, Dosierung und Anwendung, Warnungen und Vorsichtsmaßnahmen und Lieferform / Lagerung und Handhabung].
Tabelle 8. Pumpentherapie bei Typ-2-Diabetes (16 Wochen; n = 127)
| NovoLog-Pumpe | NovoLog + NPH | |
| N | 66 | 61 |
| Baseline HbA1c (%) * | 8.2 ± 1.4 | 8.0 ± 1.1 |
| Wechsel von der Basislinie HbA1c (%) | -0.6 ± 1.1 | -0.5 ± 0.9 |
| Behandlungsunterschied in HbA1c, Mittelwert (95% Konfidenzintervall) | 0.1 (0.4, 0.3) | |
| Insulindosis zu Studienbeginn (IE / kg / 24 Stunden) * | 0.7 ± 0.3 | 0.8 ± 0.5 |
| Insulindosis bei Studienende (IE / kg / 24 Stunden) * | 0.9 ± 0.4 | 0.9 ± 0.5 |
|
Grundkörpergewicht (kg) * Gewichtsänderung gegenüber dem Ausgangswert (kg) * |
96.4 ± 17.0 1.7 ± 3.7 |
96.9 ± 17.9 0.7 ± 4.1 |
* Die Werte sind Mittelwerte ± SD
Intravenöse Verabreichung von NovoLog
Siehe Sektion Klinische Pharmakologie / Pharmakodynamik.
oben
Lieferform / Lagerung und Handhabung
NovoLog ist in folgenden Packungsgrößen erhältlich: Jede Aufmachung enthält 100 Einheiten Insulin-Aspart pro ml (U-100).
| 10 ml Fläschchen | NDC 0169-7501-11 |
| 3-ml-PenFill-Patronen * | NDC 0169-3303-12 |
| 3 ml NovoLog FlexPen Fertigspritze | NDC 0169-6339-10 |
* NovoLog PenFill-Patronen sind für die Verwendung mit Novo Nordisk 3-ml-PenFill-Patronen geeignet Insulinabgabegeräte (mit oder ohne Zusatz eines NovoPen 3 PenMate) mit NovoFine Einweg Nadeln.
Empfohlene Lagerung
Unbenutztes NovoLog sollte im Kühlschrank zwischen 2 ° C und 8 ° C gelagert werden. Nicht im Gefrierschrank oder direkt neben dem Kühlelement des Kühlschranks aufbewahren. NovoLog nicht einfrieren und NovoLog nicht verwenden, wenn es eingefroren wurde. NovoLog darf nicht in eine Spritze gezogen und zur späteren Verwendung aufbewahrt werden.
Durchstechflaschen: Nach der ersten Verwendung kann eine Durchstechflasche bis zu 28 Tage lang bei Temperaturen unter 30 ° C aufbewahrt werden, sollte jedoch nicht übermäßiger Hitze oder Sonneneinstrahlung ausgesetzt werden. Geöffnete Fläschchen können gekühlt werden.
Nicht durchstochene Durchstechflaschen können bis zum auf dem Etikett angegebenen Verfallsdatum verwendet werden, wenn sie im Kühlschrank aufbewahrt werden. Bewahren Sie nicht verwendete Durchstechflaschen im Umkarton auf, damit sie sauber und lichtgeschützt bleiben.
PenFill-Patronen oder NovoLog FlexPen-Fertigspritzen:
Sobald eine Patrone oder eine NovoLog FlexPen-Fertigspritze durchstochen wurde, sollte sie bis zu 28 Tage lang bei Temperaturen unter 30 ° C aufbewahrt werden, jedoch keiner übermäßigen Hitze oder Sonneneinstrahlung ausgesetzt werden. Kartuschen oder NovoLog FlexPen-Fertigspritzen dürfen NICHT im Kühlschrank aufbewahrt werden. Halten Sie alle PenFill®-Patronen und NovoLog FlexPen-Fertigspritzen von direkter Hitze und Sonnenlicht fern. Nicht punktierte PenFill-Patronen und NovoLog FlexPen-Fertigspritzen können bis zum auf dem Etikett angegebenen Verfallsdatum verwendet werden, wenn sie im Kühlschrank aufbewahrt werden. Bewahren Sie nicht verwendete PenFill-Patronen und NovoLog FlexPen-Fertigspritzen im Karton auf, damit sie sauber und lichtgeschützt bleiben.
Entfernen Sie immer die Nadel nach jeder Injektion und bewahren Sie das 3-ml-PenFill-Kartuschen-Verabreichungsgerät oder die NovoLog FlexPen-Fertigspritze ohne Nadel auf. Dies verhindert eine Kontamination und / oder Infektion oder ein Auslaufen von Insulin und gewährleistet eine genaue Dosierung. Verwenden Sie immer eine neue Nadel für jede Injektion, um eine Kontamination zu vermeiden.
Pumpe:
NovoLog im Vorratsbehälter der Pumpe sollte mindestens alle 48 Betriebsstunden oder nach Einwirkung von Temperaturen über 37 ° C (98,6 ° F) entsorgt werden.
Zusammenfassung der Lagerbedingungen:
Die Lagerbedingungen sind in der folgenden Tabelle zusammengefasst:
Tabelle 9. Lagerbedingungen für Fläschchen, PenFill-Patronen und NovoLog FlexPen-Fertigspritze
|
NovoLog Präsentation |
Nicht in Gebrauch (ungeöffnet) Raumtemperatur (unter 30 ° C) | Nicht in Gebrauch (ungeöffnet) Gekühlt | In Gebrauch (geöffnet) Raumtemperatur (unter 30 ° C) |
| 10 ml Fläschchen | 28 tage | Bis zum Ablaufdatum | 28 Tage (gekühlt / Raumtemperatur) |
| 3 ml PenFill-Patronen | 28 tage | Bis zum Ablaufdatum |
28 tage (Nicht kühlen) |
| 3 ml NovoLog FlexPen Fertigspritze | 28 tage | Bis zum Ablaufdatum |
28 tage (Nicht kühlen) |
Aufbewahrung von verdünntem NovoLog
NovoLog, das mit Insulinverdünnungsmedium für NovoLog auf eine Konzentration von U-10 oder U-50 verdünnt wurde, kann 28 Tage lang bei Temperaturen unter 30 ° C (86 ° F) verwendet werden.
Speicherung von NovoLog in Infusionsflüssigkeiten
Infusionsbeutel, die wie unter Dosierung und Verabreichung (2) angegeben hergestellt wurden, sind bei Raumtemperatur 24 Stunden lang stabil. Etwas Insulin wird anfänglich an das Material des Infusionsbeutels adsorbiert.
Letzte Aktualisierung 12/2008
NovoLog, Insulinaspart, Patienteninformation (in reinem Englisch)
Detaillierte Informationen zu Anzeichen, Symptomen, Ursachen und Behandlungen von Diabetes
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
zurück zu: Durchsuchen Sie alle Medikamente für Diabetes


