Prandin zur Behandlung von Diabetes
Markenname: Prandin
Generischer Name: Repaglinid
Inhalt:
Beschreibung
Pharmakologie
Indikationen und Verwendung
Kontraindikationen
Vorsichtsmaßnahmen
Nebenwirkungen
Überdosis
Dosierung
Geliefert
Prandin, Patienteninformation (in reinem Englisch)
Beschreibung
Prandin® (Repaglinid) ist ein orales blutzuckersenkendes Medikament der Meglitinid-Klasse, das in der Management von Typ - 2 - Diabetes mellitus (auch als nicht insulinabhängiger Diabetes mellitus bezeichnet) oder NIDDM). Repaglinid, S (+) 2-Ethoxy-4 (2 ((3-methyl-1- (2- (1-piperidinyl) phenyl) butyl) amino) -2-oxoethyl) benzoesäure, ist chemisch nicht mit der oralen verwandt Sulfonylharnstoff-Insulin-Sekretagogen.
Die Strukturformel ist wie folgt:

Repaglinid ist ein weißes bis cremefarbenes Pulver mit der Molekularformel C27H36N204 und einem Molekulargewicht von 452,6. Prandin-Tabletten enthalten 0,5 mg, 1 mg oder 2 mg Repaglinid. Darüber hinaus enthält jede Tablette die folgenden inaktiven Inhaltsstoffe: Calciumhydrogenphosphat (wasserfrei), mikrokristalline Cellulose, Maisstärke, Polacrilin-Kalium, Povidon, Glycerin (85%), Magnesiumstearat, Meglumin, und Poloxamer. Die 1 mg- und 2 mg-Tabletten enthalten Eisenoxide (gelb bzw. rot) als Farbstoffe.
oben
Klinische Pharmakologie
Wirkmechanismus
Repaglinid senkt den Blutzuckerspiegel, indem es die Freisetzung von Insulin aus der Bauchspeicheldrüse stimuliert. Diese Aktion ist abhängig von funktionierenden Beta-Zellen (ß) in den Pankreasinseln. Die Insulinfreisetzung ist glucoseabhängig und nimmt bei niedrigen Glucosekonzentrationen ab.
Repaglinid verschließt ATP-abhängige Kaliumkanäle in der Zellmembran, indem es an charakterisierbaren Stellen bindet. Diese Kaliumkanalblockade depolarisiert die ß-Zelle, was zu einer Öffnung der Kalziumkanäle führt. Der resultierende erhöhte Calciumeinstrom induziert die Insulinsekretion. Der Ionenkanalmechanismus ist stark gewebeselektiv mit geringer Affinität zu Herz- und Skelettmuskeln.
Pharmakokinetik
Absorption:
Nach oraler Verabreichung wird Repaglinid schnell und vollständig aus dem Magen-Darm-Trakt resorbiert. Nach einmaliger und mehrfacher oraler Gabe bei gesunden Probanden oder bei Patienten treten maximale Plasmadrogenspiegel (Cmax) innerhalb von 1 Stunde (Tmax) auf. Repaglinid wird mit einer Halbwertszeit von ungefähr 1 Stunde schnell aus der Blutbahn eliminiert. Die mittlere absolute Bioverfügbarkeit beträgt 56%. Bei gleichzeitiger Gabe von Repaglinid mit Nahrungsmitteln wurde die mittlere Tmax nicht verändert, aber die mittlere Cmax und AUC (Fläche unter der Zeit / Plasma-Konzentrationskurve) wurden um 20% bzw. 12,4% verringert.
Verteilung:
Nach intravenöser (IV) Dosierung bei gesunden Probanden betrug das Verteilungsvolumen im Steady State (Vss) 31 l und die Gesamtkörperclearance (CL) 38 l / h. Die Proteinbindung und Bindung an menschliches Serumalbumin war größer als 98%.
Stoffwechsel:
Repaglinid wird nach intravenöser oder oraler Gabe durch oxidative Biotransformation und direkte Konjugation mit Glucuronsäure vollständig metabolisiert. Die Hauptmetaboliten sind eine oxidierte Dicarbonsäure (M2), das aromatische Amin (M1) und das Acylglucuronid (M7). Es wurde gezeigt, dass das Cytochrom-P-450-Enzymsystem, insbesondere 2C8 und 3A4, an der N-Dealkylierung von Repaglinid zu M2 und der weiteren Oxidation zu M1 beteiligt ist. Metaboliten tragen nicht zur glukosesenkenden Wirkung von Repaglinid bei.
Ausscheidung:
Innerhalb von 96 Stunden nach Gabe von 14C-Repaglinid als orale Einzeldosis wurden ungefähr 90% der radioaktiven Markierung im Kot und ungefähr 8% im Urin wiedergefunden. Nur 0,1% der Dosis werden als Ausgangsverbindung im Urin ausgeschieden. Der Hauptmetabolit (M2) machte 60% der verabreichten Dosis aus. Weniger als 2% des Ausgangsarzneimittels wurden im Kot gewonnen.
Pharmakokinetische Parameter:
Die pharmakokinetischen Parameter von Repaglinid wurden aus einer Einzeldosis-Crossover-Studie an gesunden Probanden und aus Parallele Mehrfachdosis-Dosis-Proportionalitätsstudie (0,5, 1, 2 und 4 mg) bei Patienten mit Typ-2-Diabetes sind in der zusammengefasst Folgende Tabelle:
| Parameter | Patienten mit Typ-2-Diabetes * |
|
Dosis 0,5 mg 1 mg 2 mg 4 mg |
AUC0-24 Std Mittelwert ± SD (ng / ml * h): 68.9 ± 154.4 125.8 ± 129.8 152.4 ± 89.6 447.4 ± 211.3 |
|
Dosis 0,5 mg 1 mg 2 mg 4 mg |
Cmax0-5 Std Mittelwert ± SD (ng / ml): 9.8 ± 10.2 18.3 ± 9.1 26.0 ± 13.0 65.8 ± 30.1 |
|
Dosis 0,5 - 4 mg |
Tmax0-5 Std Mittel (SD) 1,0 - 1,4 (0,3 - 0,5) h |
|
Dosis 0,5 - 4 mg |
T ½ Mittel (Ind Range) 1,0 - 1,4 (0,4 - 8,0) h |
| Parameter | Gesunde Probanden |
| CL basiert auf i.v. | 38 ± 16 l / h |
| Vss basierend auf i.v. | 31 ± 12 l |
| AbsBio | 56 ± 9% |
|
CL = Gesamtkörperclearance Vss= Verteilungsvolumen im eingeschwungenen Zustand AbsBio = absolute Bioverfügbarkeit |
* Vorab mit drei Mahlzeiten dosiert
Diese Daten zeigen, dass sich Repaglinid nicht im Serum anreicherte. Die Clearance von oralem Repaglinid änderte sich über den Dosisbereich von 0,5 bis 4 mg nicht, was auf eine lineare Beziehung zwischen Dosis und Plasmaspiegel hinweist.
Variabilität der Exposition:
Die AUC von Repaglinid nach mehreren Dosen von 0,25 bis 4 mg pro Mahlzeit variiert über einen weiten Bereich. Die intraindividuellen und interindividuellen Variationskoeffizienten betrugen 36% bzw. 69%. Die AUC über den therapeutischen Dosisbereich umfasste 69 bis 1005 ng / ml * h, aber in Dosis-Eskalationsstudien wurde eine AUC-Exposition von bis zu 5417 ng / ml * h ohne offensichtliche nachteilige Folgen erreicht.
Besondere Bevölkerungsgruppen:
Geriatrisch:
Gesunde Probanden wurden mit einer Dosis von 2 mg vor jeder der drei Mahlzeiten behandelt. Es gab keine signifikanten Unterschiede in der Pharmakokinetik von Repaglinid zwischen der Patientengruppe.
Pädiatrisch:
Es wurden keine Studien an pädiatrischen Patienten durchgeführt.
Geschlecht:
Ein Vergleich der Pharmakokinetik bei Männern und Frauen ergab, dass die AUC bei Frauen mit Typ-2-Diabetes über den Dosisbereich von 0,5 mg bis 4 mg um 15% bis 70% höher lag. Dieser Unterschied spiegelte sich nicht in der Häufigkeit hypoglykämischer Episoden wider (männlich: 16%; weiblich: 17%) oder andere unerwünschte Ereignisse. In Bezug auf das Geschlecht ist keine Änderung der allgemeinen Dosierungsempfehlung angezeigt, da die Dosierung für jeden Patienten individuell angepasst werden sollte, um ein optimales klinisches Ansprechen zu erzielen.
Rennen:
Es wurden keine pharmakokinetischen Studien zur Bewertung der Auswirkungen der Rasse durchgeführt, jedoch in einer einjährigen US-Studie an Patienten mit Typ-2-Diabetes war der blutzuckersenkende Effekt zwischen Kaukasiern (n = 297) und Afroamerikanern (n = 33) vergleichbar. In einer US-Dosis-Wirkungs-Studie gab es keinen offensichtlichen Unterschied in der Exposition (AUC) zwischen Kaukasiern (n = 74) und Hispanics (n = 33).
Wechselwirkungen mit anderen Medikamenten
Studien zur Wechselwirkung von Arzneimitteln, die an gesunden Probanden durchgeführt wurden, zeigen, dass Prandin keinen klinisch relevanten Einfluss auf die pharmakokinetischen Eigenschaften von Digoxin, Theophyllin oder Warfarin hatte. Die gleichzeitige Verabreichung von Cimetidin mit Prandin veränderte die Resorption und Disposition von Repaglinid nicht signifikant.
Zusätzlich wurden die folgenden Arzneimittel bei gesunden Probanden unter gleichzeitiger Anwendung von Prandin untersucht. Nachfolgend sind die Ergebnisse aufgeführt:
Gemfibrozil und Itraconazol:
Die gleichzeitige Anwendung von Gemfibrozil (600 mg) und einer Einzeldosis von 0,25 mg Prandin (nach 3 Tagen zweimal täglich 600 mg) Gemfibrozil) führte zu einer 8,1-fach höheren Repaglinid-AUC und einer verlängerten Repaglinid-Halbwertszeit von 1,3 auf 3,7 Stunden. Gleichzeitige Anwendung mit Itraconazol und einer Einzeldosis von 0,25 mg Prandin (am dritten Tag eines Bei einer Anfangsdosis von 200 mg und zweimal täglich 100 mg Itraconazol war die Dosis 1,4-fach höher Repaglinid AUC. Die gleichzeitige Anwendung von Gemfibrozil und Itraconazol mit Prandin führte zu einer 19-fach höheren AUC für Repaglinid und einer verlängerten Repaglinid-Halbwertszeit von 6,1 Stunden. Die Plasmarepaglinidkonzentration nach 7 Stunden erhöhte sich bei gleichzeitiger Gabe von Gemfibrozil um das 28,6-fache und bei der Kombination Gemfibrozil-Itraconazol um das 70,4-fache (siehe VORSICHTSMASSNAHMEN, Arzneimittel-Wechselwirkungen).
Ketoconazol:
Die gleichzeitige Anwendung von 200 mg Ketoconazol und einer Einzeldosis von 2 mg Prandin (nach 4 Tagen einmalig) Tägliches Ketoconazol (200 mg) führte zu einer Erhöhung der AUC und Cmax von Repaglinid um 15% und 16%. beziehungsweise. Die Anstiege betrugen 20,2 ng / ml bis 23,5 ng / ml für Cmax und 38,9 ng / ml * h bis 44,9 ng / ml * h für AUC.
Rifampin:
Die gleichzeitige Anwendung von 600 mg Rifampin und einer Einzeldosis von 4 mg Prandin (nach 6 Tagen einmal täglich 600 mg Rifampin) führte zu einer Verringerung der AUC und Cmax von Repaglinid um 32% bzw. 26%. Die Abnahmen betrugen 40,4 ng / ml bis 29,7 ng / ml für Cmax und 56,8 ng / ml * h bis 38,7 ng / ml * h für AUC.
In einer anderen Studie wurde die gleichzeitige Anwendung von 600 mg Rifampin und einer Einzeldosis von 4 mg Prandin (nach einmal 6 Tagen) empfohlen Tägliches Rifampin (600 mg) führte zu einer Abnahme der mittleren AUC und der mittleren Cmax von Repaglinid um 48% und 17% beziehungsweise. Die mittleren Abnahmen betrugen 54 ng / ml * h bis 28 ng / ml * h für AUC und 35 ng / ml bis 29 ng / ml für Cmax. Die alleinige Gabe von Prandin (nach 7 Tagen Rifampin 600 mg einmal täglich) führte zu einer Abnahme der mittleren AUC und Cmax von Repaglinid um 80% bzw. 79%. Die Abnahmen betrugen 54 ng / ml * h bis 11 ng / ml * h für AUC und 35 ng / ml bis 7,5 ng / ml für Cmax.
Levonorgestrel & Ethinylestradiol:
Die gleichzeitige Anwendung einer Kombinationstablette aus 0,15 mg Levonorgestrel und 0,03 mg Ethinylestradiol, die einmal täglich 21 Tage lang zusammen mit 2 mg Prandin verabreicht wurde dreimal täglich verabreicht (Tage 1 bis 4) und eine Einzeldosis am Tag 5 führten zu einem 20% igen Anstieg von Repaglinid, Levonorgestrel und Ethinylestradiol Cmax. Der Anstieg der Cmax von Repaglinid betrug von 40,5 ng / ml auf 47,4 ng / ml. Die AUC-Parameter für Ethinylestradiol waren um 20% erhöht, während die AUC-Werte für Repaglinid und Levonorgestrel unverändert blieben.
Simvastatin:
Gleichzeitige Anwendung von 20 mg Simvastatin und einer Einzeldosis von 2 mg Prandin (nach 4 Tagen Simvastatin einmal täglich) 20 mg und dreimal täglich 2 mg Prandin) führten zu einem Anstieg der Cmax von Repaglinid um 26% von 23,6 ng / ml auf 29,7 ng / ml. Die AUC war unverändert.
Nifedipin:
Gleichzeitige Anwendung von 10 mg Nifedipin mit einer Einzeldosis von 2 mg Prandin (nach 4 Tagen dreimal täglich) Nifedipin (10 mg und dreimal täglich Prandin (2 mg)) führten zu unveränderten AUC- und Cmax-Werten für beide Drogen.
Clarithromycin:
Gleichzeitige Anwendung von 250 mg Clarithromycin und einer Einzeldosis von 0,25 mg Prandin (nach 4 Tagen zweimal) Tägliches Clarithromycin (250 mg) führte zu einem Anstieg der AUC und Cmax von Repaglinid um 40% und 67%. beziehungsweise. Die Erhöhung der AUC betrug 5,3 ng / ml * h bis 7,5 ng / ml * h und die Erhöhung der Cmax betrug 4,4 ng / ml bis 7,3 ng / ml.
Trimethoprim:
Die gleichzeitige Anwendung von 160 mg Trimethoprim und einer Einzeldosis von 0,25 mg Prandin (nach 2 Tagen zweimal täglich und einer Die Gabe von 160 mg Trimethoprim am dritten Tag führte zu einem Anstieg der AUC und Cmax von Repaglinid um 61% und 41%. beziehungsweise. Die Erhöhung der AUC betrug 5,9 ng / ml * h bis 9,6 ng / ml * h und die Erhöhung der Cmax 4,7 ng / ml bis 6,6 ng / ml.
Niereninsuffizienz
Die Pharmakokinetik von Repaglinid in Einzeldosen und im Steady-State wurde bei Patienten mit Typ-2-Diabetes und normaler Nierenfunktion verglichen (CrCl> 80 ml / min), leichte bis mittelschwere Nierenfunktionsstörung (CrCl = 40 - 80 ml / min) und schwere Nierenfunktionsstörung (CrCl = 20 - 40) ml / min). Sowohl die AUC als auch die Cmax von Repaglinid waren bei Patienten mit normaler und leichter bis mäßig eingeschränkter Nierenfunktion ähnlich (Mittelwerte 56,7 ng / ml * h) vs 57,2 ng / ml * h und 37,5 ng / ml vs 37,7 ng / ml.) Patienten mit stark eingeschränkter Nierenfunktion hatten eine erhöhte mittlere AUC und Cmax Werte (98,0 ng / ml * h bzw. 50,7 ng / ml), aber diese Studie zeigte nur eine schwache Korrelation zwischen Repaglinidspiegeln und Kreatinin Spielraum. Bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung scheint eine Anpassung der Anfangsdosis nicht erforderlich zu sein. Patienten mit Typ-2-Diabetes mit schwerer Nierenfunktionsstörung sollten jedoch die Prandin-Therapie mit der 0,5-mg-Dosis einleiten. Anschließend sollten die Patienten sorgfältig titriert werden. Es wurden keine Studien bei Patienten mit einer Kreatinin-Clearance unter 20 ml / min oder bei Patienten mit Nierenversagen durchgeführt, bei denen eine Hämodialyse erforderlich war.
Leberinsuffizienz
Eine offene Einzeldosisstudie wurde an 12 gesunden Probanden und 12 Patienten mit chronischer Lebererkrankung (CLD) durchgeführt, die nach Child-Pugh-Skala und Koffein-Clearance klassifiziert wurden. Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung wiesen höhere und länger anhaltende Serumkonzentrationen von Gesamt- und ungebundenem Repaglinid auf als gesunde Probanden (AUChealthy: 91,6 ng / ml * h; AUCCLD-Patienten: 368,9 ng / ml * h; Cmax, gesund: 46,7 ng / ml; Cmax, CLD-Patienten: 105,4 ng / ml). Die AUC korrelierte statistisch mit der Coffein-Clearance. Über die Patientengruppen hinweg wurde kein Unterschied in den Glukoseprofilen beobachtet. Patienten mit eingeschränkter Leberfunktion können höheren Konzentrationen von Repaglinid und den damit verbundenen Metaboliten ausgesetzt sein als Patienten mit normaler Leberfunktion, die die üblichen Dosen erhalten. Daher sollte Prandin bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden. Längere Intervalle zwischen Dosisanpassungen sollten verwendet werden, um eine vollständige Beurteilung des Ansprechens zu ermöglichen.
Klinische Versuche
Monotherapie-Versuche
Bei 138 Patienten mit Typ-2-Diabetes wurde eine vierwöchige doppelblinde, placebokontrollierte Dosis-Wirkungs-Studie mit Dosen von 0,25 bis 4 mg durchgeführt, die zu jeder der drei Mahlzeiten eingenommen wurden. Die Prandin-Therapie führte zu einer dosisproportionalen Senkung der Glukose über den gesamten Dosisbereich. Der Plasma-Insulinspiegel stieg nach den Mahlzeiten an und kehrte vor der nächsten Mahlzeit zum Ausgangswert zurück. Der überwiegende Teil der blutzuckersenkenden Nüchternwirkung wurde innerhalb von 1-2 Wochen nachgewiesen.
In einer doppelblinden, placebokontrollierten 3-Monats-Dosistitrationsstudie wurden für jeden Patienten Prandin- oder Placebodosen verabreicht erhöhte sich wöchentlich von 0,25 mg über 0,5, 1 und 2 mg auf maximal 4 mg, bis eine nüchterne Plasmaglucose (FPG) auftrat Niveau
Prandin vs. Placebo-Behandlung: Mittlere FPG-, PPG- und HbA1c-Veränderungen gegenüber dem Ausgangswert nach 3-monatiger Behandlung:
| ||||||
| FPG (mg / dl) | PPG (mg / dl) | HbA1c (%) | ||||
| PL | R | PL | R | PL | R | |
| Grundlinie | 215.3 | 220.2 | 245.2 | 261.7 | 8.1 | 8.5 |
|
Änderung von der Grundlinie (beim letzten Besuch) |
30.3 | -31.0* | 56.5 | -47.6* |
1.1 | -0.6* |
|
FPG = Nüchternplasmaglukose PPG = postprandiale Glucose PL = Placebo (N = 33) R = Repaglinid (N = 66) |
Eine weitere placebokontrollierte Doppelblindstudie wurde bei 362 Patienten durchgeführt, die 24 Wochen lang behandelt wurden. Die Wirksamkeit von 1 und 4 mg präprandialen Dosen wurde durch Senkung des Nüchternblutzuckers und durch HbA1c am Ende der Studie gezeigt. Der HbA1c-Wert der mit Prandin behandelten Gruppen (1 und 4 mg in Kombination) war am Ende der Studie im Vergleich zu den mit Placebo behandelten Gruppen erniedrigt Gruppe bei zuvor nicht vorbehandelten Patienten und bei zuvor mit oralen Hypoglykämika behandelten Patienten um 2,1% Einheiten und 1,7% Einheiten, beziehungsweise. In dieser Studie mit fester Dosis waren Patienten, die keine orale Hypoglykämie-Therapie erhielten, und Patienten in relativ guter Verfassung Die Blutzuckerkontrolle zu Studienbeginn (HbA1c unter 8%) zeigte eine stärkere Blutzuckersenkung, einschließlich einer höheren Häufigkeit von Hypoglykämie. Patienten, die zuvor behandelt worden waren und bei denen zu Studienbeginn 8% HbA1c auftraten, berichteten über eine Hypoglykämie in der gleichen Häufigkeit wie Patienten, die randomisiert Placebo erhielten. Es gab keine durchschnittliche Gewichtszunahme, wenn Patienten, die zuvor mit oralen Hypoglykämika behandelt worden waren, auf Prandin umgestellt wurden. Die durchschnittliche Gewichtszunahme bei mit Prandin behandelten und bisher nicht mit Sulfonylharnstoff behandelten Patienten betrug 3,3%.
Die Dosierung von Prandin im Verhältnis zur mahlzeitbedingten Insulinfreisetzung wurde in drei Studien mit 58 Patienten untersucht. Die Blutzuckerkontrolle wurde während eines Zeitraums aufrechterhalten, in dem die Mahlzeit und das Dosierungsmuster variiert wurden (2, 3 oder 4 Mahlzeiten pro Tag; vor den Mahlzeiten x 2, 3 oder 4) im Vergleich zu einem Zeitraum von 3 regulären Mahlzeiten und 3 Dosen pro Tag (vor den Mahlzeiten x 3). Es wurde auch gezeigt, dass Prandin zu Beginn einer Mahlzeit, 15 Minuten vor oder 30 Minuten vor der Mahlzeit mit der gleichen blutzuckersenkenden Wirkung verabreicht werden kann.
Prandin wurde in einjährigen kontrollierten Studien mit anderen Insulinsekretagogen verglichen, um die Vergleichbarkeit von Wirksamkeit und Sicherheit zu demonstrieren. Hypoglykämie wurde bei 16% von 1228 Prandin-Patienten, 20% von 417 Glyburid-Patienten und 19% von 81 Glipizid-Patienten berichtet. Von den mit Prandin behandelten Patienten mit symptomatischer Hypoglykämie entwickelte keiner ein Koma oder erforderte einen Krankenhausaufenthalt.
Kombinationsversuche
Prandin wurde in Kombination mit Metformin bei 83 Patienten untersucht, die in Bezug auf Training, Ernährung und Metformin allein nicht zufriedenstellend eingestellt waren. Die Prandin-Dosierung wurde 4 bis 8 Wochen lang titriert, gefolgt von einer 3-monatigen Erhaltungszeit. Die Kombinationstherapie mit Prandin und Metformin führte zu einer signifikant stärkeren Verbesserung der Blutzuckerkontrolle im Vergleich zur Repaglinid- oder Metformin-Monotherapie. HbA1c wurde um 1% Einheit verbessert und FPG um zusätzliche 35 mg / dl verringert. In dieser Studie, in der die Metformin-Dosierung konstant gehalten wurde, zeigte die Kombinationstherapie von Prandin und Metformin eine dosissparende Wirkung in Bezug auf Prandin. Das Ansprechen auf die Wirksamkeit der Kombinationsgruppe wurde bei einer niedrigeren täglichen Repagliniddosis als in der Prandin-Monotherapiegruppe erreicht (siehe Tabelle).
Prandin- und Metformin-Therapie: Mittlere Veränderungen der glykämischen Parameter und des Gewichts nach 4 bis 5 Monaten Behandlung gegenüber dem Ausgangswert *
| Prandin | Kombination | Metformin | |
| N | 28 | 27 | 27 |
|
Mediane Enddosis (mg / Tag) |
12 |
6 (Prandin) 1500 (Metformin) |
1500 |
| HbA1c (% Einheiten) | -0.38 | -1.41** | -0.33 |
| FPG (mg / dl) | 8.8 | -39.2** | -4.5 |
| Gewicht (kg) | 3.0 | 2.4*** | -0.90 |
* Basierend auf der Intent-to-Treat-Analyse
** p <0,05 für paarweise Vergleiche mit Prandin und Metformin.
*** p <0,05 zum paarweisen Vergleich mit Metformin.
Ein Kombinationstherapieschema von Prandin und Pioglitazon wurde mit einer Monotherapie mit einem der beiden Wirkstoffe allein in einer Studie verglichen 24-wöchige Studie, an der 246 Patienten teilnahmen, die zuvor mit Sulfonylharnstoff oder Metformin-Monotherapie (HbA1c>) behandelt worden waren 7.0%). Die Anzahl der behandelten Patienten war: Prandin (N = 61), Pioglitazon (N = 62), Kombination (N = 123). Die Prandin-Dosierung wurde während der ersten 12 Wochen titriert, gefolgt von einer 12-wöchigen Erhaltungsperiode. Die Kombinationstherapie führte zu einer signifikant stärkeren Verbesserung der Blutzuckerkontrolle im Vergleich zur Monotherapie (Abbildung unten). Die Änderungen gegenüber dem Ausgangswert für die Kompletter in FPG (mg / dL) und HbA1c (%) betrugen: -39,8 und -0,1 für Prandin, -35,3 und -0,1 für Pioglitazon und -92,4 und -1,9 für die Kombination. In dieser Studie, in der die Pioglitazon-Dosierung konstant gehalten wurde, zeigte die Kombinationstherapiegruppe eine dosissparende Wirkung in Bezug auf Prandin (siehe Legende). Das Ansprechen auf die Wirksamkeit der Kombinationsgruppe wurde bei einer niedrigeren täglichen Repaglinid-Dosis als in der Prandin-Monotherapiegruppe erreicht. Die mittleren Gewichtszunahmen bei Kombinationstherapie mit Prandin und Pioglitazon betrugen 5,5 kg, 0,3 kg bzw. 2,0 kg.
HbA1c Werte aus der Prandin / Pioglitazon-Kombinationsstudie
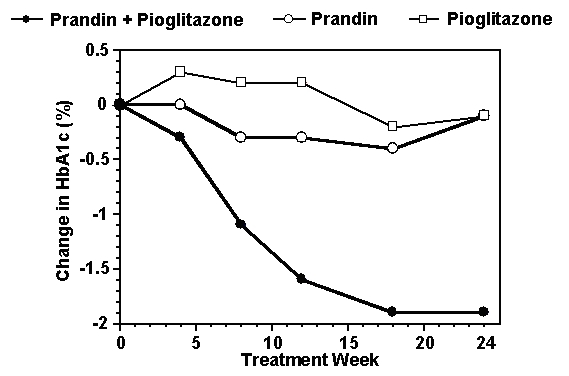
HbA1c Werte pro Studienwoche für Patienten, die die Studie abgeschlossen haben (Kombination, N = 101; Prandin, N = 35, Pioglitazon, N = 26).
Probanden mit einem FPG über 270 mg / dL wurden aus der Studie genommen.
Pioglitazon-Dosis: festgesetzt auf 30 mg / Tag; Prandin Median Enddosis: 6 mg / Tag für die Kombination und 10 mg / Tag für die Monotherapie.
Eine Kombinationstherapie mit Prandin und Rosiglitazon wurde mit einer Monotherapie mit beiden Wirkstoffen verglichen allein in einer 24-wöchigen Studie, an der 252 Patienten teilnahmen, die zuvor mit Sulfonylharnstoff oder Metformin behandelt worden waren (HbA1c > 7.0%). Die Kombinationstherapie führte zu einer signifikant stärkeren Verbesserung der Blutzuckerkontrolle im Vergleich zur Monotherapie (Tabelle unten). Die glykämischen Wirkungen der Kombinationstherapie waren sowohl in Bezug auf die tägliche Gesamtdosis von Prandin als auch in Bezug auf die tägliche Gesamtdosis von Rosiglitazon dosissparend (siehe Tabellenlegende). Ein besseres Ansprechen der Kombinationstherapiegruppe auf die Wirksamkeit wurde mit der Hälfte der mittleren Tagesdosis von Prandin und Rosiglitazon im Vergleich zu den jeweiligen Monotherapiegruppen erreicht. Die mit der Kombinationstherapie verbundene mittlere Gewichtsänderung war größer als die der Prandin-Monotherapie.
Mittlere Änderungen der glykämischen Parameter und des Gewichts gegenüber dem Ausgangswert in einer 24-wöchigen Prandin / Rosiglitazon-Kombinationsstudie *
| Prandin | Kombination | Rosiglitazon | |
| N | 63 | 127 | 62 |
| HbA1c (%) | |||
| Grundlinie | 9.3 | 9.1 | 9.0 |
| Änderung um 24 Wochen | -0.17 | -1.43** | -0.56 |
| FPG (mg / dl) | |||
| Grundlinie | 269 | 257 | 252 |
| Änderung um 24 Wochen | -54 | -94** | -67 |
| Gewichtsänderung (kg) | +1.3 | +4.5*** | +3.3 |
Mediane Enddosen: Rosiglitazon - 4 mg / Tag für die Kombination und 8 mg / Tag für die Monotherapie; Prandin - 6 mg / Tag für die Kombination und 12 mg / Tag für die Monotherapie |
* Basierend auf der Intent-to-Treat-Analyse
** p-Wert 0,001 für den Vergleich mit einer der beiden Monotherapien
*** p-Wert <0,001 zum Vergleich mit Prandin
oben
Indikationen und Verwendung
Prandin ist als Ergänzung zu Diät und Bewegung angezeigt, um die Blutzuckerkontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus zu verbessern.
oben
Kontraindikationen
Prandin ist kontraindiziert bei Patienten mit:
- Diabetische Ketoazidose mit oder ohne Koma. Dieser Zustand sollte mit Insulin behandelt werden.
- Diabetes Typ 1.
- Bekannte Überempfindlichkeit gegen das Medikament oder seine inaktiven Inhaltsstoffe.
oben
Vorsichtsmaßnahmen
Allgemeines:
Prandin ist nicht zur Anwendung in Kombination mit NPH-Insulin indiziert (vgl NEBENWIRKUNGEN, Kardiovaskuläre Ereignisse)
Makrovaskuläre Ergebnisse:
Es liegen keine klinischen Studien vor, die schlüssige Beweise für eine Reduzierung des makrovaskulären Risikos mit Prandin oder einem anderen Antidiabetikum liefern.
Hypoglykämie:
Alle oralen blutzuckersenkenden Medikamente, einschließlich Repaglinid, können Hypoglykämie hervorrufen. Die richtige Auswahl, Dosierung und Anleitung der Patienten ist wichtig, um hypoglykämische Episoden zu vermeiden. Leberinsuffizienz kann erhöhte Repaglinid-Blutspiegel verursachen und die glukoneogene Kapazität verringern, was beides das Risiko einer schweren Hypoglykämie erhöht. Ältere, geschwächte oder unterernährte Patienten sowie Patienten mit Nebennieren-, Hypophysen-, Leber- oder schweren Erkrankungen Eine Niereninsuffizienz kann besonders anfällig für die hypoglykämische Wirkung einer Glukoseabsenkung sein Drogen.
Hypoglykämie kann bei älteren Menschen und bei Menschen, die beta-adrenerge Blocker einnehmen, schwer zu erkennen sein. Eine Hypoglykämie tritt häufiger auf, wenn die Kalorienaufnahme nach schwerer oder längerer Belastung, bei Einnahme von Alkohol oder bei Verwendung von mehr als einem Glukose senkenden Medikament unzureichend ist.
Die Häufigkeit von Hypoglykämien ist bei Patienten mit Typ-2-Diabetes höher, die zuvor nicht mit oralen blutzuckersenkenden Arzneimitteln (naiv) behandelt wurden oder deren HbA1c-Wert unter 8% liegt. Prandin sollte zu den Mahlzeiten eingenommen werden, um das Risiko einer Hypoglykämie zu verringern.
Kontrollverlust des Blutzuckers:
Wenn ein Patient, der in einem Diabetes-Regime stabilisiert ist, Belastungen wie Fieber, Trauma, Infektion oder Operation ausgesetzt ist, kann es zu einem Verlust der Blutzuckerkontrolle kommen. In solchen Fällen muss Prandin möglicherweise abgesetzt und Insulin verabreicht werden. Die Wirksamkeit eines hypoglykämischen Arzneimittels bei der Senkung des Blutzuckers auf ein gewünschtes Niveau nimmt bei vielen Patienten ab Eine Zeitspanne, die auf ein Fortschreiten der Schwere des Diabetes oder auf eine verminderte Reaktion auf die Krankheit zurückzuführen sein kann Droge. Dieses Phänomen ist als sekundäres Versagen bekannt, um es von dem primären Versagen zu unterscheiden, bei dem das Medikament bei einem einzelnen Patienten unwirksam ist, wenn das Medikament zum ersten Mal verabreicht wird. Eine angemessene Anpassung der Dosis und Einhaltung der Diät sollte geprüft werden, bevor ein Patient als sekundäres Versagen eingestuft wird.
Informationen für Patienten
Die Patienten sollten über die potenziellen Risiken und Vorteile von Prandin und über alternative Therapiemethoden informiert werden. Sie sollten auch über die Wichtigkeit der Einhaltung von Ernährungsvorschriften, eines regelmäßigen Trainingsprogramms und der regelmäßigen Prüfung von Blutzucker und HbA1c informiert werden. Die Risiken einer Hypoglykämie, ihre Symptome und Behandlung sowie Bedingungen, die für ihre Entwicklung prädisponieren, und Die gleichzeitige Anwendung anderer Glukose senkender Arzneimittel sollte den Patienten und der verantwortlichen Familie erklärt werden Mitglieder. Primärer und sekundärer Ausfall sollten ebenfalls erklärt werden.
Die Patienten sollten angewiesen werden, Prandin vor den Mahlzeiten einzunehmen (2, 3 oder 4 Mal täglich vor der Mahlzeit). Die Dosen werden normalerweise innerhalb von 15 Minuten vor der Mahlzeit eingenommen, die Zeit kann jedoch von unmittelbar vor der Mahlzeit bis zu 30 Minuten vor der Mahlzeit variieren. Patienten, die eine Mahlzeit auslassen (oder eine zusätzliche Mahlzeit hinzufügen), sollten angewiesen werden, eine Dosis für diese Mahlzeit auszulassen (oder hinzuzufügen).
Labortests
Das Ansprechen auf alle Diabetestherapien sollte durch regelmäßige Messungen des Nüchternbluts überwacht werden Glukose- und glykosylierte Hämoglobinwerte mit dem Ziel, diese Werte auf den Normalwert abzusenken Angebot. Während der Dosisanpassung kann Nüchternglukose verwendet werden, um das therapeutische Ansprechen zu bestimmen. Danach sollten sowohl Glucose als auch glykosyliertes Hämoglobin überwacht werden. Glykosyliertes Hämoglobin kann besonders nützlich für die Beurteilung der langfristigen Blutzuckerkontrolle sein. Postprandiale Blutzuckerwerte können klinisch hilfreich sein bei Patienten, deren Blutzuckerwerte vor der Mahlzeit zufriedenstellend sind, deren glykämische Gesamtkontrolle (HbA1c) jedoch unzureichend ist.
Arzneimittel-Wechselwirkungen
In-vitro-Daten zeigen, dass Prandin durch die Cytochrom P450-Enzyme 2C8 und 3A4 metabolisiert wird. Folglich kann der Repaglinid-Metabolismus durch Arzneimittel verändert werden, die diese Cytochrom P450-Enzymsysteme durch Induktion und Hemmung beeinflussen. Vorsicht ist daher geboten bei Patienten, die auf Prandin sind und Inhibitoren und / oder Induktoren von CYP2C8 und CYP3A4 einnehmen. Der Effekt kann sehr signifikant sein, wenn beide Enzyme gleichzeitig inhibiert werden, was zu einer wesentlichen Erhöhung der Repaglinid-Plasmakonzentrationen führt. Arzneimittel, von denen bekannt ist, dass sie CYP3A4 hemmen, umfassen Antimykotika wie Ketoconazol, Itraconazol und antibakterielle Mittel wie Erythromycin. Zu den Wirkstoffen, von denen bekannt ist, dass sie CYP2C8 hemmen, zählen Trimethoprim, Gemfibrozil und Montelukast. Arzneimittel, die die CYP3A4- und / oder 2C8-Enzymsysteme induzieren, umfassen Rifampin, Barbiturate und Carbamezapin. Sehen KLINISCHE PHARMAKOLOGIE Abschnitt, Arzneimittel-Wechselwirkungen.
In-vivo-Daten aus einer Studie, in der die gleichzeitige Verabreichung eines Cytochrom P450-Enzyms 3A4 untersucht wurde Der Inhibitor Clarithromycin mit Prandin führte zu einem klinisch signifikanten Anstieg von Repaglinid Plasmaspiegel. Darüber hinaus wurde in einer Studie, in der die gleichzeitige Anwendung von Prandin mit Trimethoprim, einem Cytochrom-P-450-Enzym-2C8-Inhibitor, untersucht wurde, ein Anstieg der Repaglinid-Plasmaspiegel beobachtet. Dieser Anstieg der Repaglinid-Plasmaspiegel kann eine Anpassung der Prandin-Dosis erforderlich machen. Sehen KLINISCHE PHARMAKOLOGIEAbschnitt, Arzneimittel-Wechselwirkungen.
In-vivo-Daten aus einer Studie, in der die gleichzeitige Anwendung von Gemfibrozil und Prandin bei gesunden Probanden untersucht wurde, führten zu einem signifikanten Anstieg der Repaglinid-Blutspiegel. Patienten, die Prandin einnehmen, sollten nicht mit der Einnahme von Gemfibrozil beginnen. Patienten, die Gemfibrozil einnehmen, sollten Prandin nicht einnehmen. Die gleichzeitige Anwendung kann zu einer verstärkten und anhaltenden blutzuckersenkenden Wirkung von Repaglinid führen. Bei Patienten, die bereits mit Prandin und Gemfibrozil behandelt werden, ist Vorsicht geboten. Der Blutzuckerspiegel sollte überwacht werden, und die Prandin-Dosis muss möglicherweise angepasst werden. Bei Patienten, die Prandin und Gemfibrozil zusammen einnehmen, wurde über seltene Ereignisse nach Markteinführung mit schwerer Hypoglykämie berichtet. Gemfibrozil und Itraconazol hatten eine synergistische metabolische Hemmwirkung auf Prandin. Daher sollten Patienten, die Prandin und Gemfibrozil einnehmen, Itraconazol nicht einnehmen. Sehen KLINISCHE PHARMAKOLOGIE Abschnitt, Arzneimittel-Wechselwirkungen.
Die hypoglykämische Wirkung von oralen blutzuckersenkenden Wirkstoffen kann durch bestimmte Wirkstoffe, einschließlich nichtsteroidaler entzündungshemmender Wirkstoffe und anderer Wirkstoffe, verstärkt werden Das sind stark proteingebundene Salicylate, Sulfonamide, Chloramphenicol, Cumarine, Probenecid, Monoaminoxidasehemmer und Beta-Adrenoblocker Agenten. Wenn solche Arzneimittel einem Patienten verabreicht werden, der orale blutzuckersenkende Mittel erhält, sollte der Patient engmaschig auf Hypoglykämie überwacht werden. Wenn einem Patienten, der orale blutzuckersenkende Mittel erhält, solche Arzneimittel entzogen werden, sollte der Patient engmaschig auf den Verlust der Blutzuckerkontrolle überwacht werden.
Bestimmte Medikamente neigen zu Hyperglykämie und können zum Verlust der Blutzuckerkontrolle führen. Diese Medikamente umfassen die Thiazide und andere Diuretika, Corticosteroide, Phenothiazine, Schilddrüsenprodukte, Östrogene, orale Kontrazeptiva, Phenytoin, Nikotinsäure, Sympathomimetika, Calciumkanalblocker und isoniazid. Wenn diese Arzneimittel einem Patienten verabreicht werden, der orale blutzuckersenkende Mittel erhält, sollte der Patient auf den Verlust der Blutzuckerkontrolle überwacht werden. Wenn einem Patienten, der orale blutzuckersenkende Mittel erhält, diese Arzneimittel entzogen werden, sollte der Patient engmaschig auf Hypoglykämie überwacht werden.
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Langzeitstudien zur Kanzerogenität wurden 104 Wochen lang mit Dosen bis einschließlich 120 mg / kg Körpergewicht / Tag durchgeführt (Ratten) und 500 mg / kg Körpergewicht / Tag (Mäuse) oder etwa 60- bzw. 125-fache klinische Exposition gegenüber mg / m2 Basis. Bei Mäusen oder weiblichen Ratten wurde kein Hinweis auf Karzinogenität gefunden. Bei männlichen Ratten traten vermehrt gutartige Adenome der Schilddrüse und der Leber auf. Die Relevanz dieser Befunde für den Menschen ist unklar. Die wirkungslosen Dosen für diese Beobachtungen bei männlichen Ratten betrugen 30 mg / kg Körpergewicht / Tag für Schilddrüsentumoren und 60 mg / kg Körpergewicht / Tag für Schilddrüsentumoren mg / kg Körpergewicht / Tag bei Lebertumoren, die mehr als das 15- bzw. 30-fache der klinischen Exposition gegenüber mg / m2 betragen Basis.
Repaglinid war in einer Reihe von In-vivo- und In-vitro-Studien nicht genotoxisch: Bakterienmutagenese (Ames-Test), In-vitro-Forward-Cell-Mutation-Assay in V79-Zellen (HGPRT), In-vitro-Chromosomenaberrationstest in menschlichen Lymphozyten, außerplanmäßige und replizierende DNA-Synthese in Rattenleber sowie in-vivo-Maus- und Rattenmikronukleus Tests.
Die Fertilität männlicher und weiblicher Ratten wurde durch die Verabreichung von Repaglinid in Dosen von bis zu 80 mg / kg Körpergewicht / Tag (Frauen) und 300 mg / kg Körpergewicht / Tag (Männer) nicht beeinflusst. über 40-fache klinische Exposition in mg / m2.
Schwangerschaft
Schwangerschaftskategorie C
Teratogene Wirkungen
Die Sicherheit bei schwangeren Frauen wurde nicht nachgewiesen. Repaglinid war bei Ratten oder Kaninchen in Dosen, die das 40-fache (Ratten) und etwa das 0,8-fache (Kaninchen) der klinischen Exposition (auf mg / m²-Basis) während der Schwangerschaft nicht teratogen. Da Reproduktionsstudien bei Tieren nicht immer ein Hinweis auf das Ansprechen des Menschen sind, sollte Prandin während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Denn die jüngsten Informationen legen nahe, dass abnormale Blutzuckerspiegel während der Schwangerschaft mit einer höheren Inzidenz von assoziiert sind Angeborene Anomalien, viele Experten empfehlen, Insulin während der Schwangerschaft zu verwenden, um den Blutzuckerspiegel so nahe wie möglich am Normalwert zu halten wie möglich.
Nicht-teratogene Wirkungen
Nachkommen von Rattenmuttertieren, die in den Tagen 17 bis 22 der Trächtigkeit und in den Tagen 17 bis 22 der Trächtigkeit dem 15fachen der klinischen Exposition gegenüber Repaglinid in mg / m² ausgesetzt waren In der Laktation traten nicht-teratogene Skelettdeformitäten auf, die aus Verkürzung, Verdickung und Beugung des Humerus während der Nachgeburt bestanden Zeitraum. Dieser Effekt wurde bei Dosen bis zum 2,5-fachen der klinischen Exposition (auf mg / m²-Basis) an den Tagen 1 bis 22 der Schwangerschaft oder bei höheren Dosen an den Tagen 1 bis 16 der Schwangerschaft nicht beobachtet. Eine relevante Exposition beim Menschen ist bisher nicht aufgetreten, und daher kann die Sicherheit der Prandin-Verabreichung während der Schwangerschaft oder Stillzeit nicht nachgewiesen werden.
Stillende Mutter
In Reproduktionsstudien an Ratten wurden messbare Repaglinidspiegel in der Muttermilch der Muttertiere festgestellt, und bei den Jungtieren wurden erniedrigte Blutzuckerspiegel beobachtet. Cross-Foster-Studien ergaben, dass Skelettveränderungen (siehe oben, nicht-teratogene Effekte) in induziert werden könnten Kontrollwelpen, die von behandelten Muttertieren gepflegt wurden, obwohl dies in geringerem Maße vorkam als die in behandelten Welpen utero. Obwohl nicht bekannt ist, ob Repaglinid in die Muttermilch übergeht, ist bekannt, dass einige orale Wirkstoffe auf diesem Weg ausgeschieden werden. Da das Potenzial für eine Hypoglykämie bei stillenden Säuglingen besteht und aufgrund der Auswirkungen auf stillende Tiere a Es sollte entschieden werden, ob Prandin bei stillenden Müttern abgesetzt werden soll oder ob Mütter abgesetzt werden sollen Pflege. Wenn Prandin abgesetzt wird und die Ernährung allein nicht ausreicht, um den Blutzucker zu kontrollieren, sollte eine Insulintherapie in Betracht gezogen werden.
Pädiatrische Verwendung
Es wurden keine Studien an pädiatrischen Patienten durchgeführt.
Geriatrische Verwendung
In klinischen Studien mit Repaglinid über 24 Wochen waren 415 Patienten über 65 Jahre alt. In einjährigen, aktiv kontrollierten Studien wurden zwischen diesen Probanden und keine Unterschiede in Bezug auf Wirksamkeit oder unerwünschte Ereignisse festgestellt die weniger als 65, außer dem erwarteten altersbedingten Anstieg der kardiovaskulären Ereignisse, die bei Prandin und Comparator beobachtet wurden Drogen. Bei älteren Probanden gab es keine Zunahme der Häufigkeit oder des Schweregrads von Hypoglykämien. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und älteren Menschen festgestellt jüngere Patienten, aber eine größere Empfindlichkeit einiger älterer Personen gegenüber der Prandin-Therapie kann nicht ausgeschlossen werden aus.
oben
Nebenwirkungen
Hypoglykämie: Siehe VORSICHTSMASSNAHMEN undÜBERDOSIERUNG Abschnitte.
In klinischen Studien wurden 2931 Personen mit Prandin behandelt. Ungefähr 1500 dieser Personen mit Typ-2-Diabetes wurden mindestens 3 Monate lang, 1000 mindestens 6 Monate lang und 800 mindestens 1 Jahr lang behandelt. Die Mehrheit dieser Personen (1228) erhielt Prandin in einer von fünf 1-jährigen, aktiv kontrollierten Studien. Die Vergleichsmedikamente in diesen einjährigen Studien waren orale Sulfonylharnstoff-Medikamente (SU), einschließlich Glyburid und Glipizid. Über ein Jahr wurden 13% der Prandin-Patienten aufgrund unerwünschter Ereignisse abgesetzt, ebenso wie 14% der SU-Patienten. Die häufigsten unerwünschten Ereignisse, die zum Entzug führten, waren Hyperglykämie, Hypoglykämie und verwandte Symptome (siehe VORSICHTSMASSNAHMEN). Eine leichte oder mittelschwere Hypoglykämie trat bei 16% der Prandin-Patienten, 20% der Glyburid-Patienten und 19% der Glipizid-Patienten auf.
In der folgenden Tabelle sind häufige unerwünschte Ereignisse bei Prandin-Patienten im Vergleich zu Placebo (in Studien von 12 bis 24 Wochen Dauer) und Glyburid und Glipizid in einjährigen Studien aufgeführt. Das Nebenwirkungsprofil von Prandin war im Allgemeinen mit dem von Sulfonylharnstoff-Arzneimitteln (SU) vergleichbar.
Häufig gemeldete unerwünschte Ereignisse (% der Patienten) *
| VERANSTALTUNG | Prandin |
PLACEBO | Prandin |
SU |
| N = 352 | N = 108 | N = 1228 | N = 498 | |
| Placebo-kontrollierte Studien | Aktive kontrollierte Studien | |||
| Stoffwechsel | ||||
| Hypoglykämie | 31** | 7 | 16 | 20 |
| Atemwege | ||||
| URI | 16 | 8 | 10 | 10 |
| Sinusitis | 6 | 2 | 3 | 4 |
| Rhinitis | 3 | 3 | 7 | 8 |
| Bronchitis | 2 | 1 | 6 | 7 |
| Magen-Darm | ||||
| Übelkeit | 5 | 5 | 3 | 2 |
| Durchfall | 5 | 2 | 4 | 6 |
| Verstopfung | 3 | 2 | 2 | 3 |
| Erbrechen | 3 | 3 | 2 | 1 |
| Dyspepsie | 2 | 2 | 4 | 2 |
| Bewegungsapparat | ||||
| Arthralgie | 6 | 3 | 3 | 4 |
| Rückenschmerzen | 5 | 4 | 6 | 7 |
| Andere | ||||
| Kopfschmerzen | 11 | 10 | 9 | 8 |
| Parästhesie | 3 | 3 | 2 | 1 |
| Brustschmerz | 3 | 1 | 2 | 1 |
| Infektion der Harnwege | 2 | 1 | 3 | 3 |
| Zahnstörung | 2 | 0 | <1 | <1 |
| Allergie | 2 | 0 | 1 | <1 |
* Ereignisse 2% für die Prandin-Gruppe in den placebokontrollierten Studien und Ereignisse in der Placebogruppe
** Siehe Versuchsbeschreibung in KLINISCHE PHARMAKOLOGIE, Klinische Versuche.
Herz-Kreislauf-Ereignisse
In einjährigen Studien, in denen Prandin mit Sulfonylharnstoff-Arzneimitteln verglichen wurde, war die Inzidenz von Angina vergleichbar (1,8%) für beide Behandlungen, mit einer Inzidenz von Brustschmerzen von 1,8% für Prandin und 1,0% für Sulfonylharnstoffe. Die Inzidenz anderer ausgewählter kardiovaskulärer Ereignisse (Hypertonie, abnormales EKG, Myokard Infarkt, Herzrhythmusstörungen und Herzklopfen) betrugen 1% und unterschieden sich nicht zwischen Prandin und dem Vergleichspräparate.
Die Häufigkeit schwerwiegender kardiovaskulärer Nebenwirkungen, einschließlich Ischämie, war in kontrollierten Vergleichsstudien bei Repaglinid (4%) höher als bei Sulfonylharnstoff-Arzneimitteln (3%). In einjährigen kontrollierten Studien war die Prandin-Behandlung im Vergleich zu anderen oralen Hypoglykämietherapien nicht mit einer erhöhten Mortalität verbunden.
Zusammenfassung der schwerwiegenden kardiovaskulären Ereignisse (% aller Patienten mit Ereignissen) in Studien zum Vergleich von Prandin und Sulfonylharnstoffen
| Prandin | SU | |
| Total Exposed | 1228 | 498 |
| Ernste CV-Ereignisse | 4% | 3% |
| Herzisch-ischämische Ereignisse | 2% | 2% |
| Todesfälle aufgrund von CV-Ereignissen | 0.5% | 0.4% |
* Glyburid und Glipizid
Sieben kontrollierte klinische Studien umfassten die Prandin-Kombinationstherapie mit NPH-Insulin (n = 431), Insulin Formulierungen alleine (n = 388) oder in anderen Kombinationen (Sulfonylharnstoff plus NPH-Insulin oder Prandin plus Metformin) (n = 120). Bei Patienten, die mit Prandin plus behandelt wurden, traten sechs schwerwiegende unerwünschte Ereignisse mit myokardialer Ischämie auf NPH-Insulin aus zwei Studien und ein Ereignis bei Patienten, die Insulinformulierungen allein von einem anderen verwendeten Studie.
Seltene unerwünschte Ereignisse (<1% der Patienten)
Weniger häufige unerwünschte klinische oder Laborereignisse, die in klinischen Studien beobachtet wurden, waren erhöhte Leberenzyme, Thrombozytopenie, Leukopenie und anaphylaktoide Reaktionen.
Obwohl kein ursächlicher Zusammenhang mit Repaglinid festgestellt wurde, enthält die Erfahrung nach dem Inverkehrbringen Berichte über die folgenden seltenen Fälle Nebenwirkungen: Alopezie, hämolytische Anämie, Pankreatitis, Stevens-Johnson-Syndrom und schwere Leberfunktionsstörungen, einschließlich Gelbsucht und Hepatitis.
Kombinationstherapie mit Thiazolidindionen
Während der 24-wöchigen Behandlung wurden klinische Studien mit Prandin-Rosiglitazon- oder Prandin-Pioglitazon-Kombinationstherapie (insgesamt 250 Patienten in Kombinationstherapie) durchgeführt. Eine Hypoglykämie (Blutzucker <50 mg / dl) trat bei 7% der Kombinationspatienten auf, verglichen mit 7% für die Prandin-Monotherapie und 2% für Thiazolidindion Monotherapie.
Bei 12 von 250 Patienten mit Prandin-Thiazolidindion-Kombinationstherapie und 3 Patienten wurde über periphere Ödeme berichtet Von 124 Patienten mit Thiazolidindion-Monotherapie wurden in diesen Studien für Prandin keine Fälle gemeldet Monotherapie. Bereinigt um die Abbrecherquoten der Behandlungsgruppen ist dies der Prozentsatz der Patienten, bei denen periphere Ödeme aufgetreten sind pro 24-wöchiger Behandlung waren 5% für die Kombinationstherapie mit Prandin-Thiazolidindion und 4% für Thiazolidindion Monotherapie. Es gab Berichte bei 2 von 250 Patienten (0,8%), die mit Prandin-Thiazolidindion-Therapie bei Ödemen mit Herzinsuffizienz behandelt wurden. Beide Patienten hatten eine Vorerkrankung der Herzkranzgefäße und erholten sich nach Behandlung mit Diuretika. Es wurden keine vergleichbaren Fälle in den Monotherapie-Behandlungsgruppen gemeldet.
Die mittlere Gewichtsänderung gegenüber dem Ausgangswert betrug +4,9 kg für die Prandin-Thiazolidindion-Therapie. Es gab keine Patienten unter Prandin-Thiazolidindion-Kombinationstherapie, bei denen eine Erhöhung der Lebertransaminasen auftrat (definiert als das Dreifache der Obergrenze der Normalwerte).
oben
Überdosis
In einer klinischen Studie erhielten die Patienten 14 Tage lang steigende Dosen von Prandin bis zu 80 mg pro Tag. Es gab nur wenige andere nachteilige Wirkungen als die, die mit der beabsichtigten Wirkung der Senkung des Blutzuckers verbunden waren. Hypoglykämie trat nicht auf, wenn Mahlzeiten mit diesen hohen Dosen gegeben wurden. Hypoglykämische Symptome ohne Bewusstseinsverlust oder neurologische Befunde sollten aggressiv mit oraler Glukose und Anpassungen der Medikamentendosis und / oder der Essgewohnheiten behandelt werden. Eine engmaschige Überwachung kann fortgesetzt werden, bis der Arzt sicher ist, dass der Patient außer Gefahr ist. Die Patienten sollten mindestens 24 bis 48 Stunden lang engmaschig überwacht werden, da eine Hypoglykämie nach einer offensichtlichen klinischen Erholung wieder auftreten kann. Es gibt keine Hinweise darauf, dass Repaglinid durch Hämodialyse dialysierbar ist.
Schwere hypoglykämische Reaktionen mit Koma, Krampfanfällen oder anderen neurologischen Beeinträchtigungen treten selten auf, stellen jedoch medizinische Notfälle dar, die einen sofortigen Krankenhausaufenthalt erfordern. Wenn ein hypoglykämisches Koma diagnostiziert oder vermutet wird, sollte dem Patienten eine schnelle intravenöse Injektion von konzentrierter (50%) Glucoselösung verabreicht werden. Anschließend sollte kontinuierlich verdünntere (10%) Glucoselösung mit einer Geschwindigkeit infundiert werden, die den Blutglucosespiegel über 100 mg / dl hält.
oben
Dosierung und Anwendung
Es gibt kein festes Dosierungsschema für die Behandlung von Typ-2-Diabetes mit Prandin.
Der Blutzucker des Patienten sollte regelmäßig überwacht werden, um die minimale wirksame Dosis für den Patienten zu bestimmen. primäres Versagen festzustellen, d. h. unzureichende Senkung des Blutzuckers bei der maximal empfohlenen Medikamentendosis; und sekundäres Versagen, d. h. Verlust einer adäquaten blutzuckersenkenden Reaktion nach einer anfänglichen Wirksamkeitsperiode, zu detektieren. Glykosylierte Hämoglobinspiegel sind für die Überwachung des Langzeitansprechens des Patienten auf die Therapie von Wert.
Die kurzfristige Verabreichung von Prandin kann in Phasen vorübergehenden Kontrollverlusts bei Patienten ausreichend sein, die in der Regel über eine gut kontrollierte Ernährung verfügen.
Prandin-Dosen werden normalerweise innerhalb von 15 Minuten vor der Mahlzeit eingenommen, die Zeit kann jedoch von unmittelbar vor der Mahlzeit bis zu 30 Minuten vor der Mahlzeit variieren.
Anfangsdosis
Bei Patienten, die zuvor nicht behandelt wurden oder deren HbA1c <8% beträgt, sollte die Anfangsdosis 0,5 mg pro Mahlzeit betragen. Bei Patienten, die zuvor mit blutzuckersenkenden Arzneimitteln behandelt wurden und deren HbA1c-Wert bei 8% liegt, beträgt die Anfangsdosis 1 oder 2 mg pro Mahlzeit vor der Mahlzeit (siehe vorherigen Absatz).
Dosisanpassung
Dosisanpassungen sollten anhand der Blutzuckerreaktion bestimmt werden, normalerweise durch Fasten des Blutzuckers. Postprandiale Blutzuckerwerte können klinisch hilfreich sein bei Patienten, deren Blutzuckerwerte vor der Mahlzeit zufriedenstellend sind, deren Gesamtglykämiekontrolle (HbA1c) jedoch unzureichend ist. Die präprandiale Dosis sollte zu jeder Mahlzeit auf 4 mg verdoppelt werden, bis eine zufriedenstellende Blutzuckerreaktion erreicht ist. Nach jeder Dosisanpassung sollte mindestens eine Woche vergehen, um das Ansprechen zu beurteilen.
Der empfohlene Dosisbereich beträgt 0,5 mg bis 4 mg zu den Mahlzeiten. Prandin kann zwei-, drei- oder viermal täglich vorbehandelt werden, wenn sich das Essensmuster des Patienten ändert. Die maximale empfohlene Tagesdosis beträgt 16 mg.
Patienten Management
Die Langzeitwirksamkeit sollte etwa alle 3 Monate durch Messung der HbA1c-Werte überwacht werden. Die Nichteinhaltung eines geeigneten Dosierungsschemas kann zu Hypoglykämie oder Hyperglykämie führen. Patienten, die sich nicht an die vorgeschriebenen Diät- und Arzneimittelvorschriften halten, reagieren eher unbefriedigend auf die Therapie, einschließlich Hypoglykämie. Wenn bei Patienten, die eine Kombination aus Prandin und einem Thiazolidindion oder Prandin und Metformin einnehmen, eine Hypoglykämie auftritt, sollte die Dosis von Prandin reduziert werden.
Patienten, die andere orale hypoglykämische Mittel erhalten
Wenn Prandin verwendet wird, um die Therapie durch andere orale Hypoglykämika zu ersetzen, kann Prandin am Tag nach der endgültigen Gabe der Dosis begonnen werden. Die Patienten sollten dann sorgfältig auf Hypoglykämie überwacht werden, da sich die Arzneimittelwirkungen möglicherweise überschneiden. Bei einer Übertragung von Sulfonylharnstoff-Mitteln mit längerer Halbwertszeit (z. B. Chlorpropamid) auf Repaglinid kann eine engmaschige Überwachung bis zu einer Woche oder länger angezeigt sein.
Kombinationstherapie
Wenn die Prandin-Monotherapie nicht zu einer ausreichenden Blutzuckerkontrolle führt, kann Metformin oder ein Thiazolidindion zugesetzt werden. Wenn die Monotherapie mit Metformin oder Thiazolidindion keine ausreichende Kontrolle bietet, kann Prandin zugesetzt werden. Die Anfangsdosis und Dosisanpassungen für die Prandin-Kombinationstherapie sind die gleichen wie für die Prandin-Monotherapie. Die Dosis jedes Arzneimittels sollte sorgfältig angepasst werden, um die minimale Dosis zu bestimmen, die erforderlich ist, um die gewünschte pharmakologische Wirkung zu erzielen. Andernfalls kann die Inzidenz von Hypoglykämien ansteigen. Eine angemessene Überwachung der FPG- und HbA1c-Messungen sollte durchgeführt werden, um sicherzustellen, dass der Patient keiner übermäßigen Arzneimittelexposition oder einer erhöhten Wahrscheinlichkeit eines sekundären Arzneimittelversagens ausgesetzt ist.
oben
Wie geliefert
Prandin (Repaglinid) -Tabletten werden als nicht gerillte, bikonvexe Tabletten in den Stärken 0,5 mg (weiß), 1 mg (gelb) und 2 mg (Pfirsich) geliefert. Tabletten sind mit dem Stiersymbol Novo Nordisk (Apis) geprägt und farbig, um die Stärke anzuzeigen.
| 0,5 mg Tabletten (weiß) | Flaschen von 100 | NDC 00169-0081-81 |
| Flaschen von 500 | NDC 00169-0081-82 | |
| Flaschen von 1000 | NDC 00169-0081-83 | |
| 1 mg Tabletten (gelb) | Flaschen von 100 | NDC 00169-0082-81 |
| Flaschen von 500 | NDC 00169-0082-82 | |
| Flaschen von 1000 | NDC 00169-0082-83 | |
| 2 mg Tabletten (Pfirsich) | Flaschen von 100 | NDC 00169-0084-81 |
| Flaschen von 500 | NDC 00169-0084-82 | |
| Flaschen von 1000 | NDC 00169-0084-83 |
Nicht über 25 ° C lagern.
Vor Nässe schützen. Flaschen gut verschlossen halten.
In dichten Behältern mit Sicherheitsverschlüssen abfüllen.
Lizenziert unter US-Patent Nr. RE 37.035.
Prandin® ist eine eingetragene Marke von Novo Nordisk A / S.
Hergestellt in Deutschland für
Novo Nordisk Inc.
Princeton, NJ 08540
1-800-727-6500
www.novonordisk-us.com
© 2003-2008 Novo Nordisk A / S
Prandin, Patienteninformation (in reinem Englisch)
Detaillierte Informationen zu Anzeichen, Symptomen, Ursachen und Behandlungen von Diabetes
Letzte Aktualisierung 06/2009
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
zurück zu: Durchsuchen Sie alle Medikamente für Diabetes


