Lantus zur Behandlung von Diabetes
Markenname: Lantus
Generischer Name: Insulin glargin
Darreichungsform: Injektion (Lantus darf NICHT mit einem anderen Insulin oder einer anderen Lösung verdünnt oder gemischt werden.)
Inhalt:
Beschreibung
Klinische Pharmakologie
Indikationen und Verwendung
Kontraindikationen
Warnungen
Vorsichtsmaßnahmen
Nebenwirkungen
Dosierung und Anwendung
Wie wird geliefert
Lantus, Insulin glargin (rDNA-Ursprung), Patienteninformation (in reinem Englisch)
Beschreibung
Lantus® (Insulin Glargin [rDNA Origin] Injektion) ist eine sterile Lösung von Insulin Glargin zur Verwendung als Injektion. Insulin glargin ist ein rekombinantes Humaninsulinanalogon, das als parenterales blutzuckersenkendes Mittel mit einer Wirkdauer von bis zu 24 Stunden wirkt. (Sehen KLINISCHE PHARMAKOLOGIE). Lantus wird durch rekombinante DNA-Technologie unter Verwendung eines nicht pathogenen Laborstamms von Escherichia coli (K12) als Produktionsorganismus hergestellt. Insulin glargin unterscheidet sich von Humaninsulin dadurch, dass die Aminosäure Asparagin an Position A21 durch Glycin ersetzt und zwei Arginine an den C-Terminus der B-Kette angefügt werden. Chemisch handelt es sich um 21A-Gly-30Ba-L-Arg-30Bb-L-Arg-Humaninsulin mit der Summenformel C267H404N72O78S6 und einem Molekulargewicht von 6063. Es hat die folgende Strukturformel:
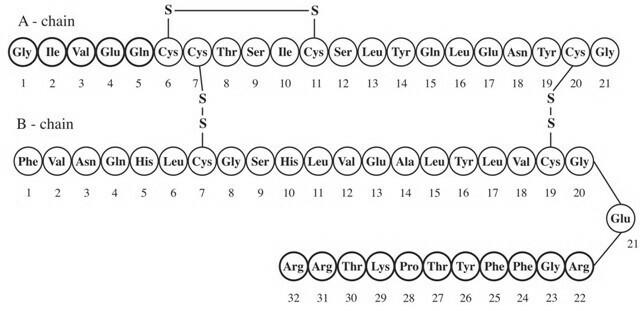
Lantus besteht aus Insulin Glargin, das in einer klaren wässrigen Flüssigkeit gelöst ist. Jeder Milliliter Lantus (Insulin-Glargin-Injektion) enthält 100 IE (3,6378 mg) Insulin-Glargin.
Inaktive Bestandteile für die 10-ml-Durchstechflasche sind 30 µg Zink, 2,7 mg m-Kresol, 20 mg Glycerin 85%, 20 µg Polysorbat 20 und Wasser zur Injektion.
Inaktive Bestandteile für die 3-ml-Patrone sind 30 µg Zink, 2,7 mg m-Kresol, 20 mg Glycerin 85% und Wasser zur Injektion.
Der pH-Wert wird durch Zugabe von wässrigen Lösungen von Salzsäure und Natriumhydroxid eingestellt. Lantus hat einen pH-Wert von ca. 4.
oben
Klinische Pharmakologie
Wirkmechanismus
Die Hauptaktivität von Insulin, einschließlich Insulin glargin, ist die Regulierung des Glukosestoffwechsels. Insulin und seine Analoga senken den Blutzuckerspiegel, indem sie die periphere Glukoseaufnahme, insbesondere von Skelettmuskeln und Fett, stimulieren und die Glukoseproduktion in der Leber hemmen. Insulin hemmt die Lipolyse in den Adipozyten, hemmt die Proteolyse und fördert die Proteinsynthese.
Pharmakodynamik
Insulin glargin ist ein Humaninsulinanalogon, dessen Wasserlöslichkeit bei neutralem pH-Wert niedrig ist. Bei pH 4 ist es wie in der Lantus-Injektionslösung vollständig löslich. Nach der Injektion in das Unterhautgewebe wird die saure Lösung neutralisiert, was zur Bildung von kleinen Mikropräzipitaten führt Mengen von Insulin glargin werden langsam freigesetzt, was zu einem relativ konstanten Konzentrations- / Zeitprofil über 24 Stunden ohne ausgeprägte Wirkung führt Gipfel. Dieses Profil ermöglicht eine einmal tägliche Dosierung als Basalinsulin eines Patienten.
In klinischen Studien ist der Glukose senkende Effekt auf molarer Basis (d. H. Wenn er in den gleichen Dosen verabreicht wird) von intravenösem Insulin Glargin ungefähr der gleiche wie der von Humaninsulin. In euglykämischen Clamp-Studien bei gesunden Probanden oder bei Patienten mit Typ-1-Diabetes setzte die Wirkung von subkutanem Insulin glargin langsamer ein als bei NPH-Humaninsulin. Das Wirkungsprofil von Insulin glargin war relativ konstant ohne ausgeprägten Peak, und die Wirkungsdauer war im Vergleich zu NPH-Humaninsulin verlängert. Abbildung 1 zeigt die Ergebnisse einer Studie bei Patienten mit Typ-1-Diabetes, die maximal 24 Stunden nach der Injektion durchgeführt wurde. Die mediane Zeit zwischen der Injektion und dem Ende der pharmakologischen Wirkung betrug 14,5 Stunden (Bereich: 9,5 bis 19,3 Stunden) für NPH Humaninsulin und 24 Stunden (Bereich: 10,8 bis> 24,0 Stunden) (24 Stunden war das Ende des Beobachtungszeitraums) für Insulin glargin.
Abbildung 1. Aktivitätsprofil bei Patienten mit Typ-1-Diabetes

* Bestimmt als Menge an Glukose, die infundiert wurde, um konstante Plasmaglukosespiegel aufrechtzuerhalten (stündliche Mittelwerte); Hinweis auf Insulinaktivität.
• Variabilität zwischen Patienten (Lebenslauf, Variationskoeffizient); Insulin Glargin 84% und NPH 78%.
Die längere Wirkdauer (bis zu 24 Stunden) von Lantus hängt direkt mit seiner langsameren Resorptionsrate zusammen und unterstützt die einmal tägliche subkutane Verabreichung. Der zeitliche Ablauf der Wirkung von Insulinen, einschließlich Lantus, kann zwischen Personen und / oder innerhalb derselben Person variieren.
Pharmakokinetik
Resorption und Bioverfügbarkeit
Nach subkutaner Injektion von Insulin glargin bei gesunden Probanden und bei Patienten mit Diabetes zeigten die Insulinserumkonzentrationen a langsamere, länger anhaltende Resorption und ein relativ konstantes Konzentrations- / Zeitprofil über 24 Stunden ohne ausgeprägten Peak im Vergleich zu NPH beim Menschen Insulin. Die Insulinkonzentrationen im Serum stimmten somit mit dem Zeitprofil der pharmakodynamischen Aktivität von Insulin glargin überein.
Nach subkutaner Injektion von 0,3 IE / kg Insulin glargin bei Patienten mit Typ-1-Diabetes wurde ein relativ konstantes Konzentrations- / Zeitprofil nachgewiesen. Die Wirkdauer nach subkutaner Verabreichung an Bauch, Deltamuskel oder Oberschenkel war ähnlich.
Stoffwechsel
Eine Metabolismusstudie am Menschen zeigt, dass Insulin Glargin teilweise am Carboxylterminus der B-Kette in der subkutanen Form metabolisiert wird Depot zur Bildung von zwei aktiven Metaboliten mit einer ähnlichen in vitro-Aktivität wie Insulin, M1 (21A-Gly-Insulin) und M2 (21A-Gly-des-30B-Thr-Insulin). Unverändertes Arzneimittel und diese Abbauprodukte sind ebenfalls im Kreislauf vorhanden.
Besondere Bevölkerungsgruppen
Alter, Rasse und Geschlecht
Informationen zum Einfluss von Alter, Rasse und Geschlecht auf die Pharmakokinetik von Lantus liegen nicht vor. In kontrollierten klinischen Studien bei Erwachsenen (n = 3890) und einer kontrollierten klinischen Studie bei pädiatrischen Patienten (n = 349) wurde jedoch die Untergruppe Analysen basierend auf Alter, Rasse und Geschlecht zeigten keine Unterschiede in Bezug auf Sicherheit und Wirksamkeit zwischen Insulin glargin und NPH beim Menschen Insulin.
Rauchen
Der Einfluss des Rauchens auf die Pharmakokinetik / Pharmakodynamik von Lantus wurde nicht untersucht.
Schwangerschaft
Die Auswirkung einer Schwangerschaft auf die Pharmakokinetik und Pharmakodynamik von Lantus wurde nicht untersucht (siehe VORSICHTSMASSNAHMEN, Schwangerschaft).
Fettleibigkeit
In kontrollierten klinischen Studien, an denen Patienten mit einem Body Mass Index (BMI) bis einschließlich 49,6 kg / m2 teilnahmen, Subgruppenanalysen basierend auf dem BMI zeigten keine Unterschiede in Bezug auf Sicherheit und Wirksamkeit zwischen Insulin glargin und NPH human Insulin.
Nierenfunktionsstörung
Der Einfluss einer Nierenfunktionsstörung auf die Pharmakokinetik von Lantus wurde nicht untersucht. In einigen Studien mit Humaninsulin wurde jedoch bei Patienten mit Nierenversagen ein erhöhter Insulinspiegel im Blut nachgewiesen. Bei Patienten mit Nierenfunktionsstörung kann eine sorgfältige Überwachung der Glukose und eine Dosisanpassung von Insulin, einschließlich Lantus, erforderlich sein (siehe Abschnitt 4.4) VORSICHTSMASSNAHMEN, Nierenfunktionsstörung).
Leberfunktionsstörung
Der Einfluss von Leberfunktionsstörungen auf die Pharmakokinetik von Lantus wurde nicht untersucht. In einigen Studien mit Humaninsulin wurde jedoch bei Patienten mit Leberversagen ein erhöhter Insulinspiegel im Blut nachgewiesen. Bei Patienten mit Leberfunktionsstörungen kann eine sorgfältige Glukoseüberwachung und Dosisanpassung von Insulin, einschließlich Lantus, erforderlich sein (siehe Abschnitt 4.4) VORSICHTSMASSNAHMEN, Leberfunktionsstörung).
Klinische Studien
Die Sicherheit und Wirksamkeit von Insulin glargin, das einmal täglich vor dem Schlafengehen verabreicht wurde, wurde mit der von einmal täglich und zweimal täglich verabreichtem NPH-Humaninsulin in offenen, randomisierten, Parallelstudien zur aktiven Kontrolle an 2327 erwachsenen Patienten und 349 pädiatrischen Patienten mit Typ - 1 - Diabetes mellitus und 1563 erwachsenen Patienten mit Typ - 2 - Diabetes mellitus (siehe Tabellen 1-3). Im Allgemeinen war die Reduktion des glykierten Hämoglobins (HbA1c) bei Lantus ähnlich wie bei NPH-Humaninsulin. Die Gesamtraten der Hypoglykämie unterschieden sich nicht zwischen Patienten mit Diabetes gegen Lantus im Vergleich zu NPH-Humaninsulin.
Typ-1-Diabetes bei Erwachsenen (siehe Tabelle 1).
In zwei großen, randomisierten, kontrollierten klinischen Studien (Studien A und B) wurden Patienten mit Typ-1-Diabetes (Studie A; n = 585, Studie B; n = 534) wurden einmal täglich vor dem Schlafengehen mit Lantus oder ein- oder zweimal täglich mit NPH-Humaninsulin randomisiert und 28 Wochen lang behandelt. Vor jeder Mahlzeit wurde normales Humaninsulin verabreicht. Lantus wurde vor dem Schlafengehen verabreicht. NPH-Humaninsulin wurde einmal täglich vor dem Schlafengehen oder morgens und vor dem Schlafengehen bei zweimal täglicher Anwendung verabreicht. In einer großen, randomisierten, kontrollierten klinischen Studie (Studie C) wurden Patienten mit Typ-1-Diabetes (n = 619) wurden 16 Wochen lang mit einem Basalbolus-Insulin-Regime behandelt, bei dem jeweils vorher Insulin lispro angewendet wurde Mahlzeit. Lantus wurde einmal täglich vor dem Schlafengehen und NPH-Humaninsulin wurde ein- oder zweimal täglich verabreicht. In diesen Studien hatten Lantus und NPH-Humaninsulin eine ähnliche Wirkung auf Glykohämoglobin mit einer ähnlichen Gesamthypoglykämierate.
Tabelle 1: Typ 1 Diabetes Mellitus-Adult
| Studie A | Studie B | Studie C | ||||
|---|---|---|---|---|---|---|
| Behandlungsdauer | 28 Wochen | 28 Wochen | 16 Wochen | |||
| Behandlung in Kombination mit | Normales Insulin | Normales Insulin | Insulin lispro | |||
| Lantus | NPH | Lantus | NPH | Lantus | NPH | |
| Anzahl der behandelten Probanden | 292 | 293 | 264 | 270 | 310 | 309 |
| HbA1c | ||||||
| Endstudy bedeuten | 8.13 | 8.07 | 7.55 | 7.49 | 7.53 | 7.60 |
| Adj. mittlere Veränderung gegenüber dem Ausgangswert | +0.21 | +0.10 | -0.16 | -0.21 | -0.07 | -0.08 |
| Lantus - NPH | +0.11 | +0.05 | +0.01 | |||
| 95% CI für Behandlungsunterschied | (-0.03; +0.24) | (-0.08; +0.19) | (-0.11; +0.13) | |||
| Basale Insulindosis | ||||||
| Endstudy bedeuten | 19.2 | 22.8 | 24.8 | 31.3 | 23.9 | 29.2 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -1.7 | -0.3 | -4.1 | +1.8 | -4.5 | +0.9 |
| Insulindosis insgesamt | ||||||
| Endstudy bedeuten | 46.7 | 51.7 | 50.3 | 54.8 | 47.4 | 50.7 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -1.1 | -0.1 | +0.3 | +3.7 | -2.9 | +0.3 |
| Nüchterner Blutzucker (mg / dl) | ||||||
| Endstudy bedeuten | 146.3 | 150.8 | 147.8 | 154.4 | 144.4 | 161.3 |
| Adj. mittlere Veränderung gegenüber dem Ausgangswert | -21.1 | -16.0 | -20.2 | -16.9 | -29.3 | -11.9 |
Typ-1-Diabetes bei Kindern (siehe Tabelle 2).
In einer randomisierten, kontrollierten klinischen Studie (Studie D) wurden pädiatrische Patienten (Altersgruppe 6 bis 15 Jahre) mit Typ-1-Diabetes untersucht (n = 349) wurden 28 Wochen lang mit einem Basal-Bolus-Insulin-Regime behandelt, bei dem jeweils vorher normales Humaninsulin verwendet wurde Mahlzeit. Lantus wurde einmal täglich vor dem Schlafengehen und NPH-Humaninsulin wurde ein- oder zweimal täglich verabreicht. In beiden Behandlungsgruppen wurden ähnliche Wirkungen auf Glykohämoglobin und das Auftreten von Hypoglykämie beobachtet.
Tabelle 2: Typ-1-Diabetes mellitus-pädiatrisch
| Studie D | ||
|---|---|---|
| Behandlungsdauer | 28 Wochen | |
| Behandlung in Kombination mit | Normales Insulin | |
| Lantus | NPH | |
| Anzahl der behandelten Probanden | 174 | 175 |
| HbA1c | ||
| Endstudy bedeuten | 8.91 | 9.18 |
| Adj. mittlere Veränderung gegenüber dem Ausgangswert | +0.28 | +0.27 |
| Lantus - NPH | +0.01 | |
| 95% CI für Behandlungsunterschied | (-0.24; +0.26) | |
| Basale Insulindosis | ||
| Endstudy bedeuten | 18.2 | 21.1 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -1.3 | +2.4 |
| Insulindosis insgesamt | ||
| Endstudy bedeuten | 45.0 | 46.0 |
| Mittlere Veränderung gegenüber dem Ausgangswert | +1.9 | +3.4 |
| Nüchterner Blutzucker (mg / dl) | ||
| Endstudy bedeuten | 171.9 | 182.7 |
| Adj. mittlere Veränderung gegenüber dem Ausgangswert | -23.2 | -12.2 |
Typ-2-Diabetes bei Erwachsenen (siehe Tabelle 3).
In einer großen, randomisierten, kontrollierten klinischen Studie (Studie E) (n = 570) wurde Lantus im Rahmen einer Therapie von 52 Wochen untersucht Kombinationstherapie mit Insulin und oralen Antidiabetika (Sulfonylharnstoff, Metformin, Acarbose oder Kombinationen davon) Drogen). Lantus, das einmal täglich vor dem Schlafengehen verabreicht wurde, war ebenso wirksam wie NPH-Humaninsulin, das einmal täglich vor dem Schlafengehen verabreicht wurde, um Glykohämoglobin und Nüchternglucose zu reduzieren. Es gab eine niedrige Hypoglykämierate, die bei mit Lantus und NPH-Humaninsulin behandelten Patienten ähnlich war. In einer großen, randomisierten, kontrollierten klinischen Studie (Studie F) bei Patienten mit Typ-2-Diabetes, die keine oralen Antidiabetika verwenden (n = 518) wurde ein Basal-Bolus-Regime von Lantus einmal täglich vor dem Schlafengehen oder NPH-Humaninsulin, das ein- oder zweimal täglich verabreicht wurde, für ausgewertet 28 Wochen. Vor den Mahlzeiten wurde nach Bedarf normales Humaninsulin verwendet. Lantus hatte eine ähnliche Wirksamkeit wie das ein- oder zweimal tägliche NPH-Humaninsulin bei der Verringerung von Glykohämoglobin und Nüchternglukose mit einer ähnlichen Häufigkeit von Hypoglykämien.
Tabelle 3: Typ 2 Diabetes Mellitus-Adult
| Studie E | Studie F | |||
|---|---|---|---|---|
| Behandlungsdauer | 52 Wochen | 28 Wochen | ||
| Behandlung in Kombination mit | Mündliche Beauftragte | Normales Insulin | ||
| Lantus | NPH | Lantus | NPH | |
| Anzahl der behandelten Probanden | 289 | 281 | 259 | 259 |
| HbA1c | ||||
| Endstudy bedeuten | 8.51 | 8.47 | 8.14 | 7.96 |
| Adj. mittlere Veränderung gegenüber dem Ausgangswert | -0.46 | -0.38 | -0.41 | -0.59 |
| Lantus - NPH | -0.08 | +0.17 | ||
| 95% CI für Behandlungsunterschied | (-0.28; +0.12) | (-0.00; +0.35) | ||
| Basale Insulindosis | ||||
| Endstudy bedeuten | 25.9 | 23.6 | 42.9 | 52.5 |
| Mittlere Veränderung gegenüber dem Ausgangswert | +11.5 | +9.0 | -1.2 | +7.0 |
| Insulindosis insgesamt | ||||
| Endstudy bedeuten | 25.9 | 23.6 | 74.3 | 80.0 |
| Mittlere Veränderung gegenüber dem Ausgangswert | +11.5 | +9.0 | +10.0 | +13.1 |
| Nüchterner Blutzucker (mg / dl) | ||||
| Endstudy bedeuten | 126.9 | 129.4 | 141.5 | 144.5 |
| Adj. mittlere Veränderung gegenüber dem Ausgangswert | -49.0 | -46.3 | -23.8 | -21.6 |
Lantus Flexible tägliche Dosierung
Die Sicherheit und Wirksamkeit von Lantus wurde vor dem Frühstück, vor dem Abendessen oder vor dem Schlafengehen verabreicht in einer großen, randomisierten, kontrollierten klinischen Studie an Patienten mit Typ - 1 - Diabetes (Studie G, n = 378). Die Patienten wurden auch zu den Mahlzeiten mit Insulin lispro behandelt. Zu verschiedenen Tageszeiten verabreichtes Lantus führte zu einer ähnlichen Verringerung des glykierten Hämoglobins im Vergleich zu der Verabreichung vor dem Schlafengehen (siehe Tabelle 4). Bei diesen Patienten liegen Daten aus der 8-Punkte-Glukoseüberwachung zu Hause vor. Der maximale mittlere Blutzuckerspiegel wurde unmittelbar vor der Injektion von Lantus unabhängig von der Verabreichungszeit, d. H. Vor dem Frühstück, vor dem Abendessen oder vor dem Schlafengehen, beobachtet.
In dieser Studie brachen 5% der Patienten im Lantus-Frühstücksarm die Behandlung wegen mangelnder Wirksamkeit ab. Kein Patient in den anderen beiden Armen wurde aus diesem Grund abgesetzt. Die routinemäßige Überwachung während dieser Studie ergab die folgenden mittleren Veränderungen des systolischen Blutdrucks: Gruppe vor dem Frühstück, 1,9 mm Hg; Pre-Dinner-Gruppe, 0,7 mm Hg; Gruppe vor dem Zubettgehen, -2,0 mm Hg.
Die Sicherheit und Wirksamkeit von Lantus vor dem Frühstück oder vor dem Schlafengehen wurde ebenfalls in einem großen randomisierten aktiv kontrollierte klinische Studie (Studie H, n = 697) bei Typ-2-Diabetes-Patienten, die nicht mehr ausreichend auf orale Mittel kontrolliert wurden Therapie. Alle Patienten dieser Studie erhielten zusätzlich 3 mg AMARYL® (Glimepirid) täglich. Vor dem Frühstück verabreichtes Lantus senkte das glykierte Hämoglobin A1c (HbA1c) mindestens genauso wirksam wie vor dem Schlafengehen verabreichtes Lantus oder vor dem Schlafengehen verabreichtes NPH-Humaninsulin (siehe Tabelle 4).
Tabelle 4: Tägliche flexible Lantus-Dosierung bei Typ 1 (Studie G) und Typ 2 (Studie H) Diabetes mellitus
| Studie G | Studie H | |||||
|---|---|---|---|---|---|---|
| Behandlungsdauer | 24 Wochen | 24 Wochen | ||||
| Behandlung in Kombination mit: | Insulin lispro | AMARYL® (Glimepirid) | ||||
| Lantus Frühstück |
Lantus Abendessen |
Lantus Bettzeit |
Lantus Frühstück |
Lantus Bettzeit |
NPH Bettzeit |
|
| ||||||
| Anzahl der behandelten Probanden* | 112 | 124 | 128 | 234 | 226 | 227 |
| HbA1c | ||||||
| Ausgangsmittelwert | 7.56 | 7.53 | 7.61 | 9.13 | 9.07 | 9.09 |
| Endstudy bedeuten | 7.39 | 7.42 | 7.57 | 7.87 | 8.12 | 8.27 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -0.17 | -0.11 | -0.04 | -1.26 | -0.95 | -0.83 |
| Basale Insulindosis (IE) | ||||||
| Endstudy bedeuten | 27.3 | 24.6 | 22.8 | 40.4 | 38.5 | 36.8 |
| Mittlere Veränderung gegenüber dem Ausgangswert | 5.0 | 1.8 | 1.5 | |||
| Gesamtinsulindosis (IE) | NA | N / A | N / A | |||
| Endstudy bedeuten | 53.3 | 54.7 | 51.5 | |||
| Mittlere Veränderung gegenüber dem Ausgangswert | 1.6 | 3.0 | 2.3 |
oben
Indikationen und Verwendung
Lantus ist für die einmal tägliche subkutane Verabreichung zur Behandlung von erwachsenen und pädiatrischen Patienten mit Typ 1 indiziert Diabetes mellitus oder erwachsene Patienten mit Typ-2-Diabetes mellitus, die basales (langwirksames) Insulin zur Kontrolle von benötigen Hyperglykämie.
oben
Kontraindikationen
Lantus ist bei Patienten kontraindiziert, die überempfindlich gegen Insulin glargin oder die sonstigen Bestandteile sind.
oben
Warnungen
Hypoglykämie ist die häufigste Nebenwirkung von Insulin, einschließlich Lantus. Wie bei allen Insulinen kann der Zeitpunkt der Hypoglykämie bei verschiedenen Insulinformulierungen unterschiedlich sein. Die Glukoseüberwachung wird für alle Patienten mit Diabetes empfohlen.
Jeder Insulinwechsel sollte vorsichtig und nur unter ärztlicher Aufsicht durchgeführt werden. Änderungen der Insulinstärke, des Dosierungszeitpunkts, des Herstellers, des Typs (z. B. regulär, NPH oder Insulinanaloga), der Spezies (Tier, Human) oder Herstellungsverfahren (rekombinante DNA im Vergleich zu Insulin tierischer Herkunft) kann die Notwendigkeit einer Änderung von Dosierung. Die gleichzeitige orale Behandlung gegen Diabetes muss möglicherweise angepasst werden.
oben
Vorsichtsmaßnahmen
Allgemeines
Lantus ist nicht zur intravenösen Anwendung bestimmt. Die verlängerte Wirkdauer von Insulin glargin hängt von der Injektion in subkutanes Gewebe ab. Die intravenöse Verabreichung der üblichen subkutanen Dosis kann zu einer schweren Hypoglykämie führen.
Lantus darf NICHT mit anderen Insulinen oder Lösungen verdünnt oder gemischt werden. Wenn Lantus verdünnt oder gemischt wird, kann die Lösung trüb werden und das pharmakokinetische / pharmakodynamische Profil (z. B. Wirkungseintritt, Zeit bis zum Spitzeneffekt) von Lantus und / oder des gemischten Insulins können unvorhersehbar verändert werden Weise. Wenn Lantus und normales Humaninsulin unmittelbar vor der Injektion bei Hunden gemischt wurden, wurde ein verzögerter Wirkungseintritt und eine Zeit bis zur maximalen Wirkung für normales Humaninsulin beobachtet. Die Gesamtbioverfügbarkeit des Gemisches war im Vergleich zu getrennten Injektionen von Lantus und normalem Humaninsulin ebenfalls leicht verringert. Die Relevanz dieser Beobachtungen bei Hunden für den Menschen ist nicht bekannt.
Wie bei allen Insulinpräparaten kann der zeitliche Verlauf der Lantus-Wirkung bei verschiedenen Personen oder zu verschiedenen Zeitpunkten variieren Zeiten in der gleichen Person und die Absorptionsrate ist abhängig von Blutversorgung, Temperatur und physischen Aktivität.
Insulin kann eine Natriumretention und ein Ödem verursachen, insbesondere wenn die zuvor schlechte Stoffwechselkontrolle durch eine intensivierte Insulintherapie verbessert wird.
Hypoglykämie
Wie bei allen Insulinpräparaten können hypoglykämische Reaktionen mit der Verabreichung von Lantus verbunden sein. Hypoglykämie ist die häufigste Nebenwirkung von Insulinen. Die Frühwarnsymptome einer Hypoglykämie können unter bestimmten Bedingungen, z. B. bei längerer Dauer, unterschiedlich oder weniger ausgeprägt sein Dauer von Diabetes, Diabetes-Nerven-Krankheit, Einsatz von Medikamenten wie Betablockern oder verstärkter Diabetes-Kontrolle (sehen VORSICHTSMASSNAHMEN, Wechselwirkungen mit anderen Medikamenten). Solche Situationen können zu schwerer Hypoglykämie (und möglicherweise zu Bewusstlosigkeit) führen, bevor die Patienten die Hypoglykämie bemerken.
Der Zeitpunkt des Auftretens einer Hypoglykämie hängt vom Wirkprofil der verwendeten Insuline ab und kann sich daher ändern, wenn das Behandlungsschema oder der Zeitpunkt der Dosierung geändert wird. Patienten, die von zweimal täglichem NPH-Insulin auf einmal tägliches Lantus umgestellt werden, sollten ihre Initiale haben Die Lantus-Dosis wurde gegenüber der vorherigen täglichen NPH-Gesamtdosis um 20% reduziert, um das Risiko einer Hypoglykämie zu verringern (sehen DOSIERUNG UND ANWENDUNG, Umstellung auf Lantus).
Die anhaltende Wirkung von subkutanem Lantus kann die Heilung von Hypoglykämie verzögern.
In einer klinischen Studie waren die Symptome einer Hypoglykämie oder der Reaktion auf ein gegenregulierendes Hormon danach ähnlich intravenöses Insulin glargin und normales Humaninsulin sowohl bei gesunden Probanden als auch bei Patienten mit Typ 1 Diabetes.
Nierenfunktionsstörung
Obwohl keine Studien bei Patienten mit Diabetes und Nierenfunktionsstörungen durchgeführt wurden, gelten die Anforderungen von Lantus kann aufgrund eines verminderten Insulinstoffwechsels verringert sein, ähnlich wie bei anderen Insulinen (sehen KLINISCHE PHARMAKOLOGIE, Besondere Bevölkerungsgruppen).
Leberfunktionsstörung
Obwohl keine Studien bei Patienten mit Diabetes und Leberfunktionsstörungen durchgeführt wurden, kann der Lantus-Bedarf verringert sein Aufgrund der verminderten Fähigkeit zur Glukoneogenese und des verminderten Insulinstoffwechsels, ähnlich wie bei anderen Insulinen (vgl KLINISCHE PHARMAKOLOGIE, Besondere Bevölkerungsgruppen).
Injektionsstelle und allergische Reaktionen
Wie bei jeder Insulintherapie kann eine Lipodystrophie an der Injektionsstelle auftreten und die Insulinabsorption verzögern. Andere Reaktionen an der Injektionsstelle unter Insulintherapie umfassen Rötung, Schmerzen, Juckreiz, Nesselsucht, Schwellung und Entzündung. Eine kontinuierliche Rotation der Injektionsstelle innerhalb eines bestimmten Bereichs kann dazu beitragen, diese Reaktionen zu verringern oder zu verhindern. Die meisten geringfügigen Reaktionen auf Insuline klingen in der Regel nach wenigen Tagen bis zu einigen Wochen ab.
Berichte über Schmerzen an der Injektionsstelle traten bei Lantus häufiger auf als bei NPH-Humaninsulin (2,7% Insulin glargin versus 0,7% NPH). Die Berichte über Schmerzen an der Injektionsstelle waren in der Regel mild und führten nicht zum Abbruch der Therapie.
Allergische Reaktionen vom Soforttyp sind selten. Solche Reaktionen auf Insulin (einschließlich Insulin Glargin) oder die sonstigen Bestandteile können zum Beispiel assoziiert sein mit generalisierten Hautreaktionen, Angioödem, Bronchospasmus, Hypotonie oder Schock und kann Leben sein bedrohlich.
Zwischenzeitliche Bedingungen
Der Insulinbedarf kann sich während der Interkurrenten wie Krankheit, emotionalen Störungen oder Stress ändern.
Informationen für Patienten
Lantus darf nur verwendet werden, wenn die Lösung klar und farblos ist und keine Partikel sichtbar sind (siehe DOSIERUNG UND ANWENDUNG, Vorbereitung und Handhabung).
Patienten müssen darauf hingewiesen werden, dass Lantus NICHT mit einem anderen Insulin oder einer anderen Lösung verdünnt oder gemischt werden darf (siehe VORSICHTSMASSNAHMEN, Allgemeines).
Die Patienten sollten in die Selbstmanagementverfahren eingewiesen werden, einschließlich der Überwachung der Glukose, der richtigen Injektionstechnik sowie des Managements von Hypoglykämie und Hyperglykämie. Die Patienten müssen in den Umgang mit besonderen Situationen wie Interkurrenten (Krankheit, Stress oder Emotionen) eingewiesen werden Störungen), eine unzureichende oder ausgelassene Insulindosis, eine versehentliche Verabreichung einer erhöhten Insulindosis, eine unzureichende Nahrungsaufnahme oder übersprungene Mahlzeiten. Weitere Informationen finden Sie im Lantus-Rundschreiben "Patienteninformationen".
Wie bei allen Patienten mit Diabetes kann die Konzentrations- und / oder Reaktionsfähigkeit aufgrund von Hypoglykämie oder Hyperglykämie beeinträchtigt sein.
Patienten mit Diabetes sollten angewiesen werden, ihren Arzt zu informieren, wenn sie schwanger sind oder eine Schwangerschaft erwägen.
Wechselwirkungen mit anderen Medikamenten
Eine Reihe von Substanzen beeinflussen den Glukosestoffwechsel und erfordern möglicherweise eine Anpassung der Insulindosis und eine besonders genaue Überwachung.
Im Folgenden sind Beispiele für Substanzen aufgeführt, die die blutzuckersenkende Wirkung und die Anfälligkeit für Hypoglykämie erhöhen können: orale Antidiabetika, ACE-Hemmer, Disopyramid, Fibrate, Fluoxetin, MAO-Hemmer, Propoxyphen, Salicylate, Somatostatinanalogon (z. B. Octreotid), Sulfonamid Antibiotika.
Im Folgenden sind Beispiele für Substanzen aufgeführt, die die blutglukosesenkende Wirkung von Insulin verringern können: Corticosteroide, Danazol, Diuretika, Sympathomimetika (z.B. Epinephrin, Albuterol, Terbutalin), Isoniazid, Phenothiazinderivate, Somatropin, Schilddrüsenhormone, Östrogene, Gestagene (z. B. in oralen Kontrazeptiva), Proteasehemmer und atypische Antipsychotika (z. B. Olanzapin und Clozapin).
Betablocker, Clonidin, Lithiumsalze und Alkohol können die blutzuckersenkende Wirkung von Insulin entweder verstärken oder abschwächen. Pentamidin kann eine Hypoglykämie verursachen, auf die manchmal eine Hyperglykämie folgt.
Darüber hinaus können unter dem Einfluss von sympatholytischen Arzneimitteln wie Betablockern, Clonidin, Guanethidin und Reserpin die Anzeichen einer Hypoglykämie vermindert sein oder fehlen.
Karzinogenese, Mutagenese, Fruchtbarkeitsstörung
Bei Mäusen und Ratten wurden zweijährige Standardkanzerogenitätsstudien mit Insulin glargin bei Dosen von bis zu 0,455 mg / kg durchgeführt, was für die Ratte gilt ungefähr das 10-fache und für die Maus ungefähr das 5-fache der empfohlenen subkutanen Anfangsdosis beim Menschen von 10 IE (0,008 mg / kg / Tag), bezogen auf mg / m2. Die Ergebnisse bei weiblichen Mäusen waren aufgrund der übermäßigen Mortalität in allen Dosisgruppen während der Studie nicht schlüssig. Histiozytome wurden an Injektionsstellen bei männlichen Ratten (statistisch signifikant) und männlichen Mäusen (nicht statistisch signifikant) in Säurevehikel enthaltenden Gruppen gefunden. Diese Tumoren wurden bei weiblichen Tieren, bei der Kochsalzlösung oder bei Insulinvergleichsgruppen unter Verwendung eines anderen Vehikels nicht gefunden. Die Relevanz dieser Befunde für den Menschen ist nicht bekannt.
Insulin glargin war in Tests zum Nachweis von Genmutationen in Bakterien und Säugerzellen (Ames- und HGPRT-Test) und in Tests zum Nachweis von Chromosomenaberrationen (Zytogenetik in vitro in V79-Zellen und in vivo in Chinesisch) Hamster).
In einer kombinierten Fertilitäts - und pränatalen und postnatalen Studie an männlichen und weiblichen Ratten bei subkutanen Dosen von bis zu 0,36 mg / kg / Tag, was ungefähr dem 7 - fachen der Dosis entspricht Die empfohlene subkutane Anfangsdosis beim Menschen von 10 IE (0,008 mg / kg / Tag), bezogen auf mg / m², war maternale Toxizität aufgrund einer dosisabhängigen Hypoglykämie, einschließlich einiger Todesfälle beobachteten. Folglich trat eine Verringerung der Aufzuchtrate nur in der Hochdosisgruppe auf. Ähnliche Wirkungen wurden bei NPH-Humaninsulin beobachtet.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C. Subkutane Reproduktions- und Teratologiestudien wurden mit Insulin glargin und normalem Humaninsulin bei Ratten und Himalaya-Kaninchen durchgeführt. Das Arzneimittel wurde weiblichen Ratten vor der Paarung, während der Paarung und während der Trächtigkeit in Dosen von bis zu 0,36 mg / kg / Tag verabreicht. Dies ist ungefähr das 7-fache der empfohlenen subkutanen Anfangsdosis von 10 IE (0,008 mg / kg / Tag) beim Menschen, bezogen auf mg / m2. Bei Kaninchen Dosen von 0,072 mg / kg / Tag, was ungefähr dem Zweifachen der empfohlenen Dosis beim Menschen entspricht Eine subkutane Anfangsdosis von 10 IE (0,008 mg / kg / Tag), bezogen auf mg / m², wurde während der Behandlung verabreicht Organogenese. Die Wirkungen von Insulin glargin unterschieden sich im Allgemeinen nicht von denen, die bei normalem Humaninsulin bei Ratten oder Kaninchen beobachtet wurden. Bei Kaninchen zeigten jedoch fünf Feten aus zwei Würfen der Hochdosisgruppe eine Erweiterung der Hirnventrikel. Fruchtbarkeit und frühe Embryonalentwicklung zeigten sich normal.
Es gibt keine gut kontrollierten klinischen Studien zur Anwendung von Insulin glargin bei schwangeren Frauen. Für Patienten mit Diabetes oder Schwangerschaftsdiabetes in der Vorgeschichte ist es wichtig, vor der Empfängnis und während der Schwangerschaft eine gute Stoffwechselkontrolle aufrechtzuerhalten. Der Insulinbedarf kann während des ersten Trimesters abnehmen, im Allgemeinen während des zweiten und dritten Trimesters zunehmen und nach der Entbindung rasch abnehmen. Eine sorgfältige Überwachung der Glukosekontrolle ist bei solchen Patienten unerlässlich. Da Reproduktionsstudien bei Tieren nicht immer ein Hinweis auf das Ansprechen des Menschen sind, sollte dieses Arzneimittel während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Stillende Mutter
Es ist nicht bekannt, ob Insulin glargin in erheblichen Mengen in die Muttermilch übergeht. Viele Medikamente, einschließlich Humaninsulin, gehen in die Muttermilch über. Aus diesem Grund ist Vorsicht geboten, wenn Lantus einer stillenden Frau verabreicht wird. Stillende Frauen müssen möglicherweise die Insulindosis und -diät anpassen.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Lantus wurde in der Altersgruppe von 6 bis 15 Jahren mit Typ-1-Diabetes nachgewiesen.
Geriatrische Verwendung
In kontrollierten klinischen Studien, in denen Insulin glargin mit NPH-Humaninsulin verglichen wurde, waren 593 von 3890 Patienten mit Typ-1- und Typ-2-Diabetes 65 Jahre und älter. Der einzige Unterschied in Bezug auf Sicherheit oder Wirksamkeit in dieser Subpopulation im Vergleich zur gesamten Studienpopulation war eine erwartete höhere Inzidenz von kardiovaskulären Ereignissen sowohl bei Insulin glargin als auch bei mit NPH behandeltem Humaninsulin Patienten.
Bei älteren Patienten mit Diabetes sollten die Anfangsdosis, die Dosiserhöhungen und die Erhaltungsdosis konservativ sein, um hypoglykämische Reaktionen zu vermeiden. Hypoglykämie kann bei älteren Menschen schwer zu erkennen sein (vgl VORSICHTSMASSNAHMENHypoglykämie).
oben
Nebenwirkungen
Zu den mit Lantus häufig verbundenen unerwünschten Ereignissen gehören:
Ganzkörper: allergische Reaktionen (vgl VORSICHTSMASSNAHMEN).
Haut und Gliedmaßen: Reaktion an der Injektionsstelle, Lipodystrophie, Pruritus, Hautausschlag (vgl VORSICHTSMASSNAHMEN).
Sonstiges: Hypoglykämie (vgl WARNUNGEN und VORSICHTSMASSNAHMEN).
In klinischen Studien an erwachsenen Patienten traten Schmerzen an der Injektionsstelle bei mit Lantus behandelten Patienten häufiger auf (2,7%) als bei mit NPH-Insulin behandelten Patienten (0,7%). Die Berichte über Schmerzen an der Injektionsstelle waren in der Regel mild und führten nicht zum Abbruch der Therapie. Andere behandlungsbedingte Reaktionen an der Injektionsstelle traten bei ähnlichen Inzidenzen sowohl mit Insulin glargin als auch mit NPH-Humaninsulin auf.
Die Retinopathie wurde in den klinischen Studien anhand der berichteten Netzhaut-Nebenwirkungen und der Fundusfotografie bewertet. Die Anzahl der für Lantus- und NPH-Behandlungsgruppen berichteten unerwünschten Ereignisse in der Netzhaut war bei Patienten mit Typ-1- und Typ-2-Diabetes ähnlich. Das Fortschreiten der Retinopathie wurde durch Fundusfotografie unter Verwendung eines Bewertungsprotokolls untersucht, das aus der Early Treatment Diabetic Retinopathy Study (ETDRS) abgeleitet wurde. In einer klinischen Studie mit Patienten mit Typ-2-Diabetes ergab sich ein Unterschied in der Anzahl der Probanden mit 3 Schritten Das Fortschreiten der ETDRS-Skala über einen Zeitraum von 6 Monaten wurde durch Fundusfotografie festgestellt (7,5% in der Lantus-Gruppe gegenüber 2,7% in der NPH) behandelte Gruppe). Die Gesamtrelevanz dieses isolierten Befundes kann aufgrund der geringen Patientenzahl nicht bestimmt werden beteiligt, die kurze Nachbeobachtungszeit und die Tatsache, dass dieser Befund in anderen klinischen nicht beobachtet wurde Studien.
oben
Überdosis
Ein Überschuss an Insulin im Verhältnis zu Nahrungsaufnahme, Energieverbrauch oder beidem kann zu schwerer und manchmal langfristiger und lebensbedrohlicher Hypoglykämie führen. Leichte Hypoglykämien können normalerweise mit oralen Kohlenhydraten behandelt werden. Möglicherweise sind Anpassungen der Medikamentendosis, der Ernährungsgewohnheiten oder des Trainings erforderlich.
Schwerwiegendere Episoden mit Koma, Anfall oder neurologischer Beeinträchtigung können mit intramuskulärem / subkutanem Glukagon oder konzentrierter intravenöser Glukose behandelt werden. Nach einer offensichtlichen klinischen Erholung von einer Hypoglykämie kann eine fortgesetzte Beobachtung und eine zusätzliche Kohlenhydrataufnahme erforderlich sein, um ein erneutes Auftreten einer Hypoglykämie zu vermeiden.
oben
Dosierung und Anwendung
Lantus ist ein rekombinantes Humaninsulinanalogon. Seine Wirksamkeit entspricht in etwa der von Humaninsulin. Es zeigt über 24 Stunden ein relativ konstantes Glukose senkendes Profil, das eine einmal tägliche Dosierung ermöglicht.
Lantus kann zu jeder Tageszeit verabreicht werden. Lantus sollte täglich einmal zur gleichen Zeit subkutan verabreicht werden. Für Patienten, die den Zeitpunkt der Dosierung mit Lantus einstellen, siehe WARNUNGEN und VORSICHTSMASSNAHMENHypoglykämie. Lantus ist nicht zur intravenösen Anwendung bestimmt (siehe VORSICHTSMASSNAHMEN). Die intravenöse Verabreichung der üblichen subkutanen Dosis kann zu einer schweren Hypoglykämie führen. Der gewünschte Blutzuckerspiegel sowie die Dosierung und der Zeitpunkt von Antidiabetika müssen individuell bestimmt werden. Die Blutzuckermessung wird für alle Patienten mit Diabetes empfohlen. Die verlängerte Aktivitätsdauer von Lantus hängt von der Injektion in den subkutanen Raum ab.
Wie bei allen Insulinen müssen die Injektionsstellen innerhalb eines Injektionsbereichs (Bauch, Oberschenkel oder Deltamuskel) von einer Injektion zur nächsten gedreht werden.
In klinischen Studien gab es keinen relevanten Unterschied in der Insulin-Glargin-Resorption nach subkutaner Verabreichung im Bauch-, Deltamuskel- oder Oberschenkelbereich. Wie bei allen Insulinen kann die Absorptionsrate und folglich der Beginn und die Dauer der Wirkung durch körperliche Betätigung und andere Variablen beeinflusst werden.
Lantus ist nicht das Insulin der Wahl zur Behandlung von Diabetes-Ketoazidose. Intravenöses kurz wirkendes Insulin ist die bevorzugte Behandlung.
Pädiatrische Verwendung
Lantus kann Kindern im Alter von 6 Jahren sicher verabreicht werden. Verabreichung an pädiatrische Patienten
Einleitung der Lantus-Therapie
In einer klinischen Studie mit Insulin-naiven Patienten mit Typ-2-Diabetes, die bereits mit oralen Antidiabetika behandelt wurden, wurde mit Lantus begonnen eine durchschnittliche Dosis von 10 IE einmal täglich und anschließend je nach Bedarf des Patienten auf eine tägliche Gesamtdosis zwischen 2 und 100 IE eingestellt IU.
Umstellung auf Lantus
Bei einem Wechsel von einem Behandlungsschema mit einem mittel- oder langwirksamen Insulin zu einem Behandlungsschema mit Lantus ist die Menge und Möglicherweise muss das Timing des kurzwirksamen Insulins oder des schnellwirksamen Insulinanalogs oder die Dosis eines oralen Antidiabetikums festgelegt werden angepasst. In klinischen Studien wurde die Anfangsdosis normalerweise nicht geändert, wenn Patienten von einmal täglichem NPH-Humaninsulin oder ultralentem Humaninsulin auf einmal tägliches Lantus umgestellt wurden. Wenn die Patienten jedoch einmal täglich von zweimal täglichem NPH-Humaninsulin auf Lantus umgestellt wurden, um das Risiko einer Hypoglykämie zu verringern, war dies der Anfang Die Dosis (IE) wurde normalerweise um ungefähr 20% (verglichen mit der gesamten täglichen IE von NPH-Humaninsulin) reduziert und dann basierend auf dem Ansprechen des Patienten angepasst (sehen VORSICHTSMASSNAHMENHypoglykämie).
Während des Transfers und in den ersten Wochen danach wird ein Programm zur engmaschigen Stoffwechselüberwachung unter ärztlicher Aufsicht empfohlen. Die Menge und das Timing des kurzwirksamen Insulins oder des schnellwirksamen Insulinanalogons müssen möglicherweise angepasst werden. Dies gilt insbesondere für Patienten mit erworbenen Antikörpern gegen Humaninsulin, die hohe Insulindosen benötigen, und tritt bei allen Insulinanaloga auf. Möglicherweise ist eine Dosisanpassung von Lantus und anderen Insulinen oder oralen Antidiabetika erforderlich. zum Beispiel, wenn sich der Zeitpunkt der Dosierung, das Gewicht oder der Lebensstil des Patienten ändert oder andere Umstände eintreten, die die Anfälligkeit für Hypoglykämie oder Hyperglykämie erhöhen (siehe VORSICHTSMASSNAHMENHypoglykämie).
Möglicherweise muss die Dosis auch bei gleichzeitiger Erkrankung angepasst werden (siehe VORSICHTSMASSNAHMEN, Intercurrent Conditions).
Vorbereitung und Handhabung
Parenterale Arzneimittel sollten vor der Verabreichung visuell überprüft werden, wenn die Lösung und der Behälter dies zulassen. Lantus darf nur verwendet werden, wenn die Lösung klar und farblos ist und keine Partikel sichtbar sind.
Mischen und Verdünnen: Lantus darf NICHT mit anderen Insulinen oder Lösungen verdünnt oder gemischt werden (siehe VORSICHTSMASSNAHMEN, Allgemeines).
Durchstechflasche: Die Spritzen dürfen keine anderen Arzneimittel oder Rückstände enthalten.
Kartuschensystem: Bei OptiClik®, dem Insulinabgabegerät für Lantus, kann Lantus aus dem Kartuschensystem in eine U-100-Spritze gezogen und injiziert werden.
oben
Wie wird geliefert
Lantus 100 Einheiten pro ml (U-100) ist in folgenden Packungsgrößen erhältlich:
10-ml-Fläschchen (NDC 0088-2220-33)
3 ml Kartuschensystem1Packung mit 5 Stück (NDC 0088-2220-52)
1Kartuschensysteme dürfen nur in OptiClik® (Insulin Delivery Device) verwendet werden.
Lager
Ungeöffnetes Fläschchen- / Patronensystem
Ungeöffnete Lantus-Durchstechflaschen und Patronensysteme sollten im Kühlschrank bei 2 ° C bis 8 ° C aufbewahrt werden. Lantus darf nicht im Gefrierschrank aufbewahrt werden und darf nicht gefrieren.
Werfen Sie es weg, wenn es eingefroren wurde.
Offenes (In-Use) Vial / Cartridge-System
Geöffnete Durchstechflaschen, auch gekühlt, müssen innerhalb von 28 Tagen nach dem ersten Gebrauch verwendet werden. Sie müssen verworfen werden, wenn sie nicht innerhalb von 28 Tagen verwendet werden. Wenn eine Kühlung nicht möglich ist, kann die offene Durchstechflasche bis zu 28 Tage lang ohne direkte Wärme- und Lichteinwirkung aufbewahrt werden, sofern die Temperatur nicht höher als 30 ° C ist.
Das geöffnete (in Gebrauch befindliche) Patronensystem in OptiClik® darf NICHT gekühlt werden, sondern muss bei Raumtemperatur (unter 30 ° C) aufbewahrt werden, um direkter Hitze und Lichteinwirkung vorzubeugen. Das geöffnete (in Gebrauch befindliche) Kartuschensystem in OptiClik®, das bei Raumtemperatur aufbewahrt wird, muss nach 28 Tagen entsorgt werden. Lagern Sie OptiClik® niemals mit oder ohne Patronensystem im Kühlschrank.
Lantus darf nicht im Gefrierschrank aufbewahrt werden und darf nicht gefrieren. Werfen Sie es weg, wenn es eingefroren wurde.
Diese Lagerbedingungen sind in der folgenden Tabelle zusammengefasst:
| Nicht in Gebrauch (ungeöffnet) Gekühlt |
Nicht in Gebrauch (ungeöffnet) Zimmertemperatur |
In Benutzung (geöffnet) (Siehe Temperatur unten) |
|
|---|---|---|---|
| 10 ml Fläschchen | Bis zum Ablaufdatum | 28 tage | 28 tage Gekühlt oder Raumtemperatur |
| 3 ml Kartuschensystem | Bis zum Ablaufdatum | 28 tage | 28 tage Gekühlt oder Raumtemperatur |
| 3 ml Kartusche System in OptiClik eingefügt® |
28 tage Nur Raumtemperatur (Nicht kühlen) |
Hergestellt für ein vertrieben von:
sanofi-aventis U.S. LLC
Bridgewater NJ 08807
Hergestellt in Deutschland
www. Lantus.com
© 2006 sanofi-aventis U.S. LLC
OptiClik® ist eine eingetragene Marke von sanofi-aventis U.S. LLC, Bridgewater NJ 08807
Letzte Aktualisierung 04/2006
Lantus, Insulin glargin (rDNA-Ursprung), Patienteninformation (in reinem Englisch)
Detaillierte Informationen zu Anzeichen, Symptomen, Ursachen und Behandlungen von Diabetes
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
zurück zu: Durchsuchen Sie alle Medikamente für Diabetes

