Levemir zur Behandlung von Diabetes
Markenname: Levemir
Generischer Name: Insulin Detemir
Darreichungsform: Injektion
Inhalt:
Beschreibung
Klinische Pharmakologie
Klinische Studien
Indikationen und Verwendung
Kontraindikationen
Warnungen
Vorsichtsmaßnahmen
Nebenwirkungen
Überdosierung
Dosierung und Anwendung
Wie geliefert
Levemir, Insulindetemir (rDNA-Ursprung), Patienteninformation (in reinem Englisch)
Beschreibung
Levemir® (Insulin Detemir [rDNA Origin] -Injektion) ist eine sterile Lösung von Insulin Detemir zur Verwendung als Injektion. Insulin Detemir ist ein lang wirkendes basales Insulinanalogon mit einer Wirkdauer von bis zu 24 Stunden, das von a Prozess, der die Expression von rekombinanter DNA in Saccharomyces cerevisiae gefolgt von einer Chemikalie umfasst Änderung.
Insulindetemir unterscheidet sich von Humaninsulin dadurch, dass die Aminosäure Threonin in Position B30 weggelassen wurde und eine C14-Fettsäurekette an die Aminosäure B29 gebunden wurde. Insulindetemir hat eine Molekularformel von C267H402O76N64S6 und ein Molekulargewicht von 5916,9. Es hat die folgende Struktur:
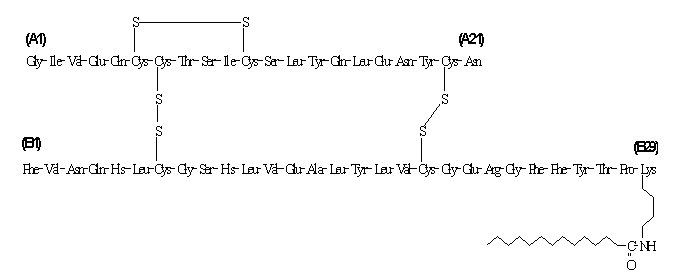
Levemir ist eine klare, farblose, wässrige, neutrale sterile Lösung. Jeder Milliliter Levemir enthält 100 U (14,2 mg / ml) Insulindetemir. Jeder Milliliter Levemir 10 ml Fläschchen enthält die inaktiven Inhaltsstoffe 65,4 µg Zink, 2,06 mg m-Kresol, 30,0 mg Mannit, 1,80 mg Phenol, 0,89 mg Dinatriumphosphatdihydrat, 1,17 mg Natriumchlorid und Wasser zur Injektion. Jeder Milliliter Levemir 3 ml PenFill®-Kartusche, FlexPen® und InnoLet® enthält die inaktiven Inhaltsstoffe 65,4 µg Zink, 2,06 mg m-Kresol, 16,0 mg Glycerin, 1,80 mg Phenol, 0,89 mg Dinatriumphosphatdihydrat, 1,17 mg Natriumchlorid und Wasser zur Injektion. Salzsäure und / oder Natriumhydroxid können zugesetzt werden, um den pH-Wert einzustellen. Levemir hat einen pH-Wert von ca. 7,4.
oben
Klinische Pharmakologie
Wirkmechanismus
Die Hauptaktivität von Insulindetemir ist die Regulierung des Glukosestoffwechsels. Insuline, einschließlich Insulin Detemir, üben ihre spezifische Wirkung durch Bindung an Insulinrezeptoren aus.
Rezeptorgebundenes Insulin senkt den Blutzucker, indem es die zelluläre Aufnahme von Glukose in Skelettmuskel und Fett erleichtert und die Glukoseabgabe aus der Leber hemmt. Insulin hemmt die Lipolyse im Adipozyten, hemmt die Proteolyse und verbessert die Proteinsynthese.
Pharmakodynamik
Insulindetemir ist ein lösliches, lang wirkendes basales Humaninsulinanalogon mit einem relativ flachen Wirkungsprofil. Die mittlere Wirkdauer von Insulindetemir lag zwischen 5,7 Stunden bei der niedrigsten Dosis und 23,2 Stunden bei der höchsten Dosis (Probenahmezeitraum 24 Stunden).
Die verlängerte Wirkung von Levemir wird durch die langsame systemische Absorption von Insulindetemir vermittelt Moleküle von der Injektionsstelle aufgrund der starken Selbstassoziation der Wirkstoffmoleküle und des Albumins Bindung. Insulindetemir wird langsamer auf periphere Zielgewebe verteilt, da Insulindetemir im Blutkreislauf stark an Albumin gebunden ist.
1 zeigt die Ergebnisse der Glukoseinfusionsrate aus einer Glukoseklemmstudie bei Patienten mit Typ-1-Diabetes.
Abbildung 1: Aktivitätsprofile bei Patienten mit Typ-1-Diabetes in einer 24-Stunden-Glukose-Clamp-Studie
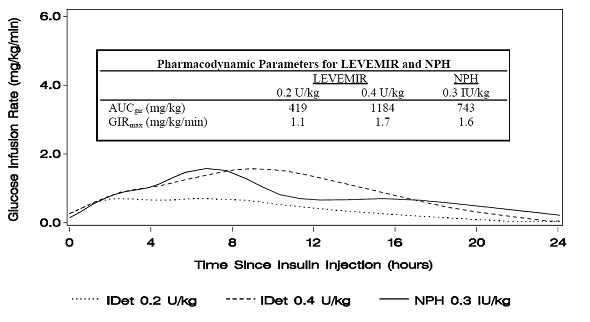
2 zeigt die Ergebnisse der Glukoseinfusionsrate aus einer 16-stündigen Glukoseklemmstudie bei Patienten mit Typ-2-Diabetes. Die Klemmstudie wurde nach Protokoll nach 16 Stunden beendet.
Abbildung 2: Aktivitätsprofile bei Patienten mit Typ-2-Diabetes in einer 16-stündigen Glukose-Clamp-Studie

Bei Dosen im Intervall von 0,2 bis 0,4 U / kg übt Levemir 3 bis 4 Stunden bis etwa 14 Stunden nach der Verabreichung der Dosis mehr als 50% seiner maximalen Wirkung aus.
In einer Glucose-Clamp-Studie trennte sich der gesamte glucodynamische Effekt (AUCGIR 0-24h) [Mittelwert mg / kg ± SD (CV)] von vier Die subkutanen Injektionen in den Oberschenkel betrugen 1702,6 ± 489 mg / kg (29%) in der Levemir-Gruppe und 1922,8 ± 765 mg / kg (40%). für NPH. Die klinische Bedeutung dieses Unterschieds wurde nicht nachgewiesen.
Pharmakokinetik
Absorption
Nach subkutaner Injektion von Insulin Detemir bei gesunden Probanden und bei Patienten mit Diabetes Insulin Detemir Serumkonzentrationen zeigten eine langsamere, länger anhaltende Absorption über 24 Stunden im Vergleich zu NPH-Menschen Insulin.
Die maximale Serumkonzentration (Cmax) wird zwischen 6 und 8 Stunden nach der Verabreichung erreicht.
Die absolute Bioverfügbarkeit von Insulin Detemir beträgt ca. 60%.
Verteilung und Beseitigung
Mehr als 98% Insulindetemir im Blutkreislauf sind an Albumin gebunden. Levemir hat ein kleines scheinbares Verteilungsvolumen von ungefähr 0,1 l / kg. Levemir hat nach subkutaner Verabreichung je nach Dosis eine terminale Halbwertszeit von 5 bis 7 Stunden.
Besondere Populationen
Kinder und Jugendliche - Die pharmakokinetischen Eigenschaften von Levemir wurden bei Kindern (6 bis 12 Jahre) und Jugendlichen (13 bis 17 Jahre) sowie Erwachsenen mit Typ-1-Diabetes untersucht. Ähnlich wie bei NPH-Humaninsulin wurden bei Kindern um 10% bzw. 24% im Vergleich zu Jugendlichen und Erwachsenen eine geringfügig höhere Plasmafläche unter der Kurve (AUC) und Cmax beobachtet. Es gab keinen Unterschied in der Pharmakokinetik zwischen Jugendlichen und Erwachsenen.
Geriatrie - In einer klinischen Studie, in der Unterschiede in der Pharmakokinetik einer einzelnen subkutanen Dosis von Levemir bei jungen Patienten (25 bis 35 Jahre) untersucht wurden Jahre) im Vergleich zu älteren (68 Jahre) gesunden Probanden wurden höhere Insulin-AUC-Spiegel (bis zu 35%) bei älteren Probanden aufgrund einer verringerten gefunden Spielraum. Wie bei anderen Insulinpräparaten sollte Levemir immer gemäß den individuellen Anforderungen titriert werden.
Geschlecht - In kontrollierten klinischen Studien ist in pharmakokinetischen Parametern basierend auf Subgruppenanalysen kein klinisch relevanter Unterschied zwischen den Geschlechtern festzustellen.
Rennen - In zwei Studien an gesunden japanischen und kaukasischen Probanden wurden keine klinisch relevanten Unterschiede bei den pharmakokinetischen Parametern festgestellt. Die Pharmakokinetik und Pharmakodynamik von Levemir wurden in einer Klammerstudie untersucht, in der Patienten mit Typ-2-Diabetes kaukasischer, afroamerikanischer und lateinamerikanischer Herkunft verglichen wurden. Die Dosis-Wirkungs-Beziehungen waren für Levemir in diesen drei Populationen vergleichbar.
Nierenfunktionsstörung - Personen mit Nierenfunktionsstörung zeigten im Vergleich zu gesunden Probanden keinen Unterschied in den pharmakokinetischen Parametern. Literaturberichte haben jedoch gezeigt, dass die Clearance von Humaninsulin bei Patienten mit eingeschränkter Nierenfunktion verringert ist. Bei Patienten mit Nierenfunktionsstörung kann eine sorgfältige Glukoseüberwachung und Dosisanpassung von Insulin, einschließlich Levemir, erforderlich sein (siehe Abschnitt 4.4) VORSICHTSMASSNAHMEN, Nierenfunktionsstörung).
Leberfunktionsstörung - Bei Personen mit schwerer Leberfunktionsstörung ohne Diabetes wurde im Vergleich zu gesunden Probanden eine niedrigere AUC beobachtet. Bei Patienten mit Leberfunktionsstörung kann eine sorgfältige Überwachung der Glukose und eine Dosisanpassung von Insulin, einschließlich Levemir, erforderlich sein (siehe Abschnitt 4.4) VORSICHTSMASSNAHMEN, Leberfunktionsstörung).
Schwangerschaft - Der Einfluss der Schwangerschaft auf die Pharmakokinetik und Pharmakodynamik von Levemir wurde nicht untersucht (vgl VORSICHTSMASSNAHMEN, Schwangerschaft ).
Rauchen - Die Wirkung des Rauchens auf die Pharmakokinetik und Pharmakodynamik von Levemir wurde nicht untersucht.
oben
Klinische Studien
Die Wirksamkeit und Sicherheit von Levemir, das einmal täglich vor dem Schlafengehen oder zweimal täglich (vor dem Frühstück und vor dem Schlafengehen, vor dem Frühstück und zum Abendessen oder in Intervallen von 12 Stunden) gegeben wurde, wurde verglichen mit die von einmal täglichem oder zweimal täglichem NPH-Humaninsulin oder einmal täglichem Insulin glargin in nicht verblindeten, randomisierten Parallelstudien an 6004 Patienten mit Diabetes (3724 mit Typ 1 und 2280 mit Typ 2). Im Allgemeinen erreichten Patienten, die mit Levemir behandelt wurden, einen ähnlichen Grad an Blutzuckerkontrolle wie Patienten, die mit NPH-Humaninsulin oder Insulin glargin behandelt wurden, gemessen mit glykosyliertem Hämoglobin (HbA1c).
Typ 1 Diabetes - Erwachsene
In einer nicht verblindeten klinischen Studie (Studie A, n = 409) wurden erwachsene Patienten mit Typ-1-Diabetes randomisiert Behandlung entweder mit Levemir in Intervallen von 12 Stunden, Levemir morgens und vor dem Schlafengehen oder mit NPH-Humaninsulin morgens und vor dem Schlafengehen Bettzeit. Insulinaspart wurde auch vor jeder Mahlzeit verabreicht. Nach 16-wöchiger Behandlung zeigten die mit Levemir behandelten kombinierten Patienten ähnliche HbA1c- und Nüchternplasmaglukosereduktionen (FPG) wie die mit NPH behandelten Patienten (Tabelle 1). Unterschiede im Zeitpunkt der Levemir-Verabreichung (oder der flexiblen Dosierung) hatten keinen Einfluss auf HbA1c, FPG, Körpergewicht oder das Risiko für hypoglykämische Episoden.
Die mit Levemir erzielte glykämische Gesamtkontrolle wurde mit der mit Insulin glargin in einer randomisierten, nicht verblindeten klinischen Studie verglichen (Studie B, n = 320), bei denen Patienten mit Typ-1-Diabetes 26 Wochen lang entweder zweimal täglich (morgens und vor dem Schlafengehen) mit Levemir oder einmal täglich (vor dem Schlafengehen) mit Insulin behandelt wurden glargin. Insulinaspart wurde vor jeder Mahlzeit verabreicht. Levemir-behandelte Patienten wiesen einen ähnlichen Rückgang des HbA1c auf wie Insulin-Glargin-behandelte Patienten.
In einer randomisierten, kontrollierten klinischen Studie (Studie C, n = 749) wurden Patienten mit Typ-1-Diabetes mit behandelt einmal täglich (vor dem Schlafengehen) Levemir oder NPH Humaninsulin, beide in Kombination mit humanem löslichem Insulin vor jeder Mahlzeit für 6 Monate. Levemir und NPH-Humaninsulin hatten eine ähnliche Wirkung auf HbA1c.
Tabelle 1: Wirksamkeit und Insulindosierung bei Typ-1-Diabetes mellitus bei Erwachsenen
| Studie A | ||
| Behandlungsdauer | 16 Wochen | |
| Behandlung in Kombination mit | NovoLog® (Insulin Aspart) | |
| Levemir | NPH | |
| Anzahl der behandelten Probanden | 276 | 133 |
| HbA1c (%) | ||
| Grundlinie | 8.64 | 8.51 |
| Studienende bereinigter Mittelwert | 7.76 | 7.94 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -0.82 | -0.60 |
| Nüchternplasmaglukose (mg / dl) | ||
| Studienende bereinigter Mittelwert | 168 | 202 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -42.48 | -10.80 |
| Tägliche Basalinsulindosis (U / kg) | ||
| Prestudy bedeuten | 0.36 | 0.39 |
| Studienende bedeuten | 0.49 | 0.45 |
| Tägliche Bolusinsulindosis (U / kg) | ||
| Prestudy bedeuten | 0.40 | 0.40 |
| Studienende bedeuten | 0.38 | 0.38 |
Basiswerte wurden als Kovariaten in eine ANCOVA-Analyse einbezogen. |
Typ 1 Diabetes - pädiatrisch
In einer nicht verblindeten, randomisierten, kontrollierten klinischen Studie (Studie D, n = 347) wurden pädiatrische Patienten (Alter 6 bis 17) mit Typ-1-Diabetes 26 Wochen lang mit einem Basal-Bolus-Insulin-Regime behandelt. Levemir und NPH-Humaninsulin wurden ein- oder zweimal täglich (vor dem Schlafengehen oder morgens und vor dem Schlafengehen) entsprechend dem Dosierungsschema vor der Einnahme verabreicht. Bolusinsulinaspart wurde vor jeder Mahlzeit verabreicht. Levemir-behandelte Patienten wiesen eine ähnliche Abnahme von HbA1c auf wie NPH-Humaninsulin.
Tabelle 2: Wirksamkeit und Insulindosierung bei Typ-1-Diabetes mellitus bei Kindern
| Studie D | ||
| Behandlungsdauer | 26 Wochen | |
| Behandlung in Kombination mit | NovoLog® (Insulin Aspart) | |
| Levemir | NPH | |
| Anzahl der behandelten Probanden | 232 | 115 |
| HbA1c (%) | ||
| Grundlinie | 8.75 | 8.77 |
| Studienende bereinigter Mittelwert | 8.02 | 7.93 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -0.72 | -0.80 |
| Nüchternplasmaglukose (mg / dl) | ||
| Studienende bereinigter Mittelwert | 151.92 | 172.44 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -45.00 | -19.98 |
| Tägliche Basalinsulindosis (U / kg) | ||
| Prestudy bedeuten | 0.48 | 0.49 |
| Studienende bedeuten | 0.67 | 0.64 |
| Tägliche Bolusinsulindosis (U / kg) | ||
| Prestudy bedeuten | 0.52 | 0.47 |
| Studienende bedeuten | 0.52 | 0.51 |
Typ 2 Diabetes - Erwachsene
In einer 24-wöchigen, nicht verblindeten, randomisierten klinischen Studie (Studie E, n = 476) wurde Levemir, das zweimal täglich (vor dem Frühstück und am Abend) verabreicht wurde, mit einem ähnlichen NPH-Regime verglichen Humaninsulin im Rahmen einer Kombinationstherapie mit einem oder zwei der folgenden oralen Antidiabetika (Metformin, Insulinsekretagogum oder β-Glucosidase) Inhibitor). Levemir und NPH senkten in ähnlicher Weise HbA1c gegenüber dem Ausgangswert (Tabelle 3).
Tabelle 3: Wirksamkeit und Insulindosierung bei Typ-2-Diabetes mellitus
| Studie E | ||
| Behandlungsdauer | 24 Wochen | |
| Behandlung in Kombination mit | OAD | |
| Levemir | NPH | |
| Anzahl der behandelten Probanden | 237 | 239 |
| HbA1c (%) | ||
| Grundlinie | 8.61 | 8.51 |
| Studienende bereinigter Mittelwert | 6.58 | 6.46 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -1.84 | -1.90 |
| Anteil erreicht HbA1c ≤ 7% | 70% | 74% |
| Nüchternplasmaglukose (mg / dl) | ||
| Studienende bereinigter Mittelwert | 119.16 | 113.40 |
| Mittlere Veränderung gegenüber dem Ausgangswert | -75.96 | -74.34 |
| Tägliche Insulindosis (U / kg) | ||
| Studienende bedeuten | 0.77 | 0.52 |
In einer 22-wöchigen, nicht verblindeten, randomisierten klinischen Studie (Studie F, n = 395) bei Erwachsenen mit Typ-2-Diabetes wurden Levemir und NPH-Humaninsulin ein- oder zweimal täglich als Teil einer Basalbolus-Therapie verabreicht. Levemir hatte, gemessen mit HbA1c oder FPG, eine ähnliche Wirksamkeit wie NPH-Humaninsulin.
oben
Indikationen und Verwendung
Levemir ist für die ein- oder zweimal tägliche subkutane Anwendung zur Behandlung von erwachsenen und pädiatrischen Patienten mit Typ 1 angezeigt Diabetes mellitus oder erwachsene Patienten mit Typ - 2 - Diabetes mellitus, die basales (langwirksames) Insulin zur Kontrolle von benötigen Hyperglykämie.
oben
Kontraindikationen
Levemir ist bei Patienten kontraindiziert, die überempfindlich gegen Insulin Detemir oder einen seiner sonstigen Bestandteile sind.
oben
Warnungen
Hypoglykämie ist die häufigste Nebenwirkung einer Insulintherapie, einschließlich Levemir. Wie bei allen Insulinen kann der Zeitpunkt der Hypoglykämie bei verschiedenen Insulinformulierungen unterschiedlich sein.
Die Glukoseüberwachung wird für alle Patienten mit Diabetes empfohlen.
Levemir darf nicht in Insulin-Infusionspumpen angewendet werden.
Jede Änderung der Insulindosis sollte vorsichtig und nur unter ärztlicher Aufsicht vorgenommen werden. Änderungen der Insulinstärke, des Dosierungszeitpunkts, des Herstellers, des Typs (z. B. regulär, NPH oder Insulinanaloga), der Spezies (Tier, Mensch) oder Herstellungsverfahren (rDNA im Vergleich zu Insulin tierischer Herkunft) können eine Änderung von erforderlich machen Dosierung.
Die gleichzeitige orale Behandlung mit Antidiabetika muss möglicherweise angepasst werden.
oben
Vorsichtsmaßnahmen
Allgemeines
Eine unzureichende Dosierung oder ein Absetzen der Behandlung kann zu Hyperglykämie und bei Patienten mit Typ-1-Diabetes zu diabetischer Ketoazidose führen. Die ersten Symptome einer Hyperglykämie treten normalerweise allmählich über einen Zeitraum von Stunden oder Tagen auf. Dazu gehören Übelkeit, Erbrechen, Schläfrigkeit, gerötete trockene Haut, trockener Mund, vermehrtes Wasserlassen, Durst und Appetitlosigkeit sowie Acetonatem. Unbehandelte hyperglykämische Ereignisse können tödlich sein.
Levemir ist nicht zur intravenösen oder intramuskulären Anwendung bestimmt. Die verlängerte Wirkdauer von Insulin detemir hängt von der Injektion in subkutanes Gewebe ab. Die intravenöse Verabreichung der üblichen subkutanen Dosis kann zu einer schweren Hypoglykämie führen. Die Resorption nach intramuskulärer Verabreichung ist sowohl schneller als auch umfangreicher als die Resorption nach subkutaner Verabreichung.
Levemir darf nicht mit anderen Insulinpräparaten verdünnt oder gemischt werden (siehe VORSICHTSMASSNAHMEN, Mischen von Insulinen).
Insulin kann eine Natriumretention und ein Ödem verursachen, insbesondere wenn die zuvor schlechte Stoffwechselkontrolle durch eine intensivierte Insulintherapie verbessert wird.
Lipodystrophie und Überempfindlichkeit gehören zu den möglichen klinischen Nebenwirkungen, die mit der Verwendung aller Insuline verbunden sind.
Wie bei allen Insulinpräparaten kann der zeitliche Verlauf der Levemir-Wirkung bei verschiedenen Personen oder bei Patienten variieren unterschiedliche Zeiten im selben Individuum und ist abhängig von der Injektionsstelle, der Blutversorgung, der Temperatur und der körperlichen Verfassung Aktivität.
Eine Anpassung der Insulindosierung kann erforderlich sein, wenn Patienten ihre körperliche Aktivität oder ihren üblichen Ernährungsplan ändern.
Hypoglykämie
Wie bei allen Insulinpräparaten können mit der Verabreichung von Levemir hypoglykämische Reaktionen verbunden sein. Hypoglykämie ist die häufigste Nebenwirkung von Insulinen. Frühwarnsymptome einer Hypoglykämie können unter bestimmten Bedingungen, wie z Dauer von Diabetes, diabetischer Nervenkrankheit, Verwendung von Medikamenten wie Betablockern oder verstärkter Diabetes-Kontrolle (sehen VORSICHTSMASSNAHMEN, Wechselwirkungen mit anderen Medikamenten). Solche Situationen können zu schwerer Hypoglykämie (und möglicherweise zu Bewusstlosigkeit) führen, bevor die Patienten die Hypoglykämie bemerken.
Der Zeitpunkt des Auftretens einer Hypoglykämie hängt vom Wirkprofil der verwendeten Insuline ab und kann sich daher ändern, wenn das Behandlungsschema oder der Zeitpunkt der Dosierung geändert wird. Bei Patienten, die von anderen mittel- oder langwirksamen Insulinpräparaten auf ein- oder zweimal tägliches Levemir umgestellt werden, können Dosierungen von Einheit zu Einheit verschrieben werden. Wie bei allen Insulinpräparaten müssen jedoch möglicherweise Dosis und Zeitpunkt der Verabreichung angepasst werden, um das Risiko einer Hypoglykämie zu verringern (siehe Abschnitt 4.4) DOSIERUNG UND ANWENDUNG, Umstellung auf Levemir).
Nierenfunktionsstörung
Wie bei anderen Insulinen müssen die Anforderungen für Levemir bei Patienten mit Nierenfunktionsstörungen möglicherweise angepasst werden (siehe Abschnitt 4.4) KLINISCHE PHARMAKOLOGIEPharmakokinetik).
Leberfunktionsstörung
Wie bei anderen Insulinen müssen die Anforderungen für Levemir bei Patienten mit Leberfunktionsstörungen möglicherweise angepasst werden (siehe KLINISCHE PHARMAKOLOGIEPharmakokinetik).
Injektionsstelle und allergische Reaktionen
Wie bei jeder Insulintherapie kann eine Lipodistrophie an der Injektionsstelle auftreten und die Insulinabsorption verzögern. Andere Reaktionen an der Injektionsstelle unter Insulintherapie können Rötung, Schmerzen, Juckreiz, Nesselsucht, Schwellung und Entzündung umfassen. Eine kontinuierliche Rotation der Injektionsstelle innerhalb eines bestimmten Bereichs kann dazu beitragen, diese Reaktionen zu verringern oder zu verhindern. Reaktionen klingen normalerweise nach wenigen Tagen bis zu einigen Wochen ab. In seltenen Fällen können Reaktionen an der Injektionsstelle ein Absetzen von Levemir erforderlich machen.
In einigen Fällen können diese Reaktionen mit anderen Faktoren als Insulin zusammenhängen, z. B. mit Reizstoffen in einem Hautreinigungsmittel oder einer schlechten Injektionstechnik.
Systemische Allergie: Eine allgemeine Allergie gegen Insulin, die seltener, aber möglicherweise schwerwiegender ist, kann Hautausschlag verursachen (einschließlich Juckreiz) am ganzen Körper, Kurzatmigkeit, Keuchen, Blutdrucksenkung, schneller Puls oder Schwitzen. Schwere Fälle einer generalisierten Allergie, einschließlich einer anaphylaktischen Reaktion, können lebensbedrohlich sein.
Zwischenzeitliche Bedingungen
Der Insulinbedarf kann sich bei gleichzeitigen Erkrankungen, emotionalen Störungen oder anderen Belastungen ändern.
Informationen für Patienten
Levemir darf nur angewendet werden, wenn die Lösung klar und farblos erscheint und keine sichtbaren Partikel aufweist (siehe DOSIERUNG UND ANWENDUNG, Vorbereitung und Handhabung). Die Patienten sollten über mögliche Risiken und Vorteile der Levemir-Therapie einschließlich der möglichen Nebenwirkungen informiert werden. Den Patienten sollte eine kontinuierliche Aufklärung und Beratung zu Insulintherapien, Injektionstechnik, Lebensstilmanagement, regelmäßiger Glukoseüberwachung und regelmäßigen Tests auf glykosyliertes Hämoglobin angeboten werden. Erkennung und Behandlung von Hypo- und Hyperglykämie, Einhaltung der Essensplanung, Komplikationen der Insulintherapie, zeitliche Festlegung der Dosierung, Gebrauchsanweisung für Injektionsgeräte und ordnungsgemäße Lagerung von Insulin. Die Patienten sollten darüber informiert werden, dass häufige, vom Patienten durchgeführte Blutzuckermessungen erforderlich sind, um eine wirksame Blutzuckerkontrolle zu erreichen und sowohl Hyperglykämie als auch Hypoglykämie zu vermeiden. Die Patienten müssen in den Umgang mit besonderen Situationen wie Interkurrenten (Krankheit, Stress oder Emotionen) eingewiesen werden Störungen), eine unzureichende oder ausgelassene Insulindosis, eine versehentliche Verabreichung einer erhöhten Insulindosis, eine unzureichende Nahrungsaufnahme oder übersprungene Mahlzeiten. Weitere Informationen finden Sie im Levemir-Rundschreiben "Patienteninformationen".
Wie bei allen Patienten mit Diabetes kann die Konzentrations- und / oder Reaktionsfähigkeit aufgrund von Hypoglykämie oder Hyperglykämie beeinträchtigt sein.
Patienten mit Diabetes sollten angewiesen werden, ihre Ärztin oder ihren Arzt zu informieren, wenn sie schwanger sind oder eine Schwangerschaft erwägen (siehe VORSICHTSMASSNAHMEN, Schwangerschaft ).
Labortests
Wie bei jeder Insulintherapie sollte das therapeutische Ansprechen auf Levemir durch regelmäßige Blutzuckertests überwacht werden. Die regelmäßige Messung von HbA1c wird zur Überwachung der langfristigen Blutzuckerkontrolle empfohlen.
Wechselwirkungen mit anderen Medikamenten
Eine Reihe von Substanzen beeinflussen den Glukosestoffwechsel und erfordern möglicherweise eine Anpassung der Insulindosis und eine besonders genaue Überwachung.
Im Folgenden sind Beispiele für Substanzen aufgeführt, die die blutzuckersenkende Wirkung von Insulin verringern können: Corticosteroide, Danazol, Diuretika, Sympathomimetika (z.B. Epinephrin, Albuterol, Terbutalin), Isoniazid, Phenothiazinderivate, Somatropin, Schilddrüsenhormone, Östrogene, Gestagene (z.B. oral) Verhütungsmittel).
Im Folgenden sind Beispiele für Substanzen aufgeführt, die die blutzuckersenkende Wirkung von Insulin und die Anfälligkeit für Hypoglykämie erhöhen können: orales Antidiabetikum Arzneimittel, ACE-Hemmer, Disopyramid, Fibrate, Fluoxetin, MAO-Hemmer, Propoxyphen, Salicylate, Somatostatinanalogon (z. B. Octreotid) und Sulfonamid Antibiotika.
Betablocker, Clonidin, Lithiumsalze und Alkohol können die blutzuckersenkende Wirkung von Insulin entweder verstärken oder abschwächen. Pentamidin kann eine Hypoglykämie verursachen, auf die manchmal eine Hyperglykämie folgt. Darüber hinaus können unter dem Einfluss von sympatholytischen Arzneimitteln wie Betablockern, Clonidin, Guanethidin und Reserpin die Anzeichen einer Hypoglykämie vermindert sein oder fehlen.
Die Ergebnisse von In-vitro- und In-vivo-Proteinbindungsstudien zeigen, dass es keine klinisch relevante Wechselwirkung zwischen Insulin Detemir und Fettsäuren oder anderen proteingebundenen Arzneimitteln gibt.
Mischen von Insulinen
Wenn Levemir mit anderen Insulinpräparaten gemischt wird, kann sich das Wirkprofil einer oder beider Einzelkomponenten ändern. Das Mischen von Levemir mit Insulinaspart, einem schnell wirkenden Insulinanalogon, führte zu einer Verringerung der AUC um etwa 40% (0 bis 2 Stunden) und Cmax für Insulinaspart im Vergleich zu separaten Injektionen, wenn das Verhältnis von Insulinaspart zu Levemir geringer war als 50%.
Levemir darf NICHT mit anderen Insulinpräparaten gemischt oder verdünnt werden.
Karzinogenese, Mutagenese, Fruchtbarkeitsstörung
Standardstudien zur Kanzerogenität über 2 Jahre bei Tieren wurden nicht durchgeführt. Insulin detemir wurde in der In - vitro - Umkehrmutationsstudie von Bakterien, menschlicher Chromosomenaberrationstest von peripheren Blutlymphozyten und in vivo Maus Mikronukleus-Test.
Schwangerschaft
Schwangerschaftskategorie C
Teratogene Wirkungen
In einer Fruchtbarkeits- und Embryonalentwicklungsstudie wurde weiblichen Ratten vor der Paarung, während der Paarung und während der Paarung Insulin Detemir verabreicht während der gesamten Schwangerschaft in Dosen von bis zu 300 nmol / kg / Tag (3-fache der empfohlenen menschlichen Dosis, basierend auf der Plasma-Fläche unter der Kurve (AUC) Verhältnis). Dosen von 150 und 300 nmol / kg / Tag erzeugten eine Anzahl von Würfen mit viszeralen Anomalien. Während der Organogenese wurden Kaninchen Dosen von bis zu 900 nmol / kg / Tag (ungefähr das 135-fache der empfohlenen menschlichen Dosis, basierend auf dem AUC-Verhältnis) verabreicht. In einer Dosis von 900 nmol / kg / Tag wurde ein medikamentöser Anstieg der Inzidenz von Feten mit Gallenblasenanomalien wie kleinen, zweilappigen, gegabelten und fehlenden Gallenblasen beobachtet. Die embryofetalen Entwicklungsstudien an Ratten und Kaninchen, die gleichzeitige Humaninsulin-Kontrollgruppen umfassten zeigten, dass Insulindetemir und Humaninsulin ähnliche Wirkungen in Bezug auf Embryotoxizität hatten und Teratogenität.
Stillende Mutter
Es ist nicht bekannt, ob Levemir in erheblichen Mengen in die Muttermilch übergeht. Aus diesem Grund ist Vorsicht geboten, wenn Levemir einer stillenden Mutter verabreicht wird. Patienten mit Diabetes, die stillen, müssen möglicherweise die Insulindosis, den Ernährungsplan oder beides anpassen.
Pädiatrische Verwendung
In einer kontrollierten klinischen Studie waren die HbA1c-Konzentrationen und die Hypoglykämieraten bei Patienten, die mit Levemir behandelt wurden, und bei Patienten, die mit NPH-Humaninsulin behandelt wurden, ähnlich.
Geriatrischer Gebrauch
85 (Typ-1-Studien) und 363 (Typ-2-Studien) waren 65 Jahre und älter. Es wurden keine allgemeinen Unterschiede in Bezug auf Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben ergeben Es wurden keine Unterschiede in den Reaktionen zwischen älteren und jüngeren Patienten festgestellt, jedoch kann eine größere Empfindlichkeit einiger älterer Personen nicht ausgeschlossen werden. Bei älteren Patienten mit Diabetes sollten die Anfangsdosis, die Dosiserhöhungen und die Erhaltungsdosis konservativ sein, um hypoglykämische Reaktionen zu vermeiden. Hypoglykämie kann bei älteren Menschen schwer zu erkennen sein.
oben
Nebenwirkungen
Unerwünschte Ereignisse im Zusammenhang mit der Behandlung mit Humaninsulin sind:
Ganzkörper: allergische Reaktionen (vgl VORSICHTSMASSNAHMEN, Allergie).
Haut und Anhänge: Lipodystrophie, Juckreiz, Hautausschlag. Leichte Reaktionen an der Injektionsstelle traten unter Levemir häufiger auf als unter NPH-Humaninsulin und klangen in der Regel nach wenigen Tagen bis wenigen Wochen ab (vgl VORSICHTSMASSNAHMEN, Allergie).
Andere:
Hypoglykämie: (siehe WARNUNGEN und VORSICHTSMASSNAHMEN).
In Studien von bis zu 6 Monaten Dauer bei Patienten mit Typ 1 und Typ 2 Diabetes trat die Inzidenz einer schweren Hypoglykämie mit Levemir war vergleichbar mit der Inzidenz von NPH und erwartungsgemäß bei Patienten mit Typ - 1 - Diabetes insgesamt höher (Tabelle 1) 4).
Gewichtszunahme:
In Studien mit einer Dauer von bis zu 6 Monaten bei Patienten mit Typ 1- und Typ 2-Diabetes war Levemir mit einer etwas geringeren Gewichtszunahme als NPH assoziiert (Tabelle 4). Ob diese beobachteten Unterschiede echte Unterschiede in den Wirkungen von Levemir und NPH-Insulin darstellen, ist nicht bekannt, da diese Studien nicht verblindet waren und die Protokolle (z. B. Diät- und Übungsanweisungen und Überwachung) waren nicht speziell auf die Erforschung von Hypothesen gerichtet, die sich auf Gewichtseffekte der Behandlungen beziehen verglichen. Die klinische Signifikanz der beobachteten Unterschiede ist nicht belegt.
Tabelle 4: Sicherheitsinformationen zu klinischen Studien *
| ||||||
| Gewicht (kg) | Hypoglykämie (Ereignisse / Thema / Monat) | |||||
| Behandlung | Anzahl der Probanden | Grundlinie | Behandlungsende | Haupt†| Geringerc | |
| Typ 1 | ||||||
| Studie A | Levemir | N = 276 | 75.0 | 75.1 | 0.045 | 2.184 |
| NPH | N = 133 | 75.7 | 76.4 | 0.035 | 3.063 | |
| Studie C | Levemir | N = 492 | 76.5 | 76.3 | 0.029 | 2.397 |
| NPH | N = 257 | 76.1 | 76.5 | 0.027 | 2.564 | |
| Studie D Pädiatrisch | Levemir | N = 232 | N / A | N / A | 0.076 | 2.677 |
| NPH | N = 115 | N / A | N / A | 0.083 | 3.203 | |
| Typ 2 | ||||||
| Studie E | Levemir | N = 237 | 82.7 | 83.7 | 0.001 | 0.306 |
| NPH | N = 239 | 82.4 | 85.2 | 0.006 | 0.595 | |
| Studie F | Levemir | N = 195 | 81.8 | 82.3 | 0.003 | 0.193 |
| NPH | N = 200 | 79.6 | 80.9 | 0.006 | 0.235 |
oben
Überdosierung
Hypoglykämie kann als Folge eines Überschusses an Insulin in Bezug auf Nahrungsaufnahme, Energieverbrauch oder beides auftreten. Leichte Hypoglykämien können normalerweise mit oraler Glukose behandelt werden. Möglicherweise sind Anpassungen der Medikamentendosis, der Ernährungsgewohnheiten oder des Trainings erforderlich. Schwerwiegendere Episoden mit Koma, Anfall oder neurologischer Beeinträchtigung können mit intramuskulärem / subkutanem Glukagon oder konzentrierter intravenöser Glukose behandelt werden. Nach einer offensichtlichen klinischen Erholung von einer Hypoglykämie kann eine fortgesetzte Beobachtung und eine zusätzliche Kohlenhydrataufnahme erforderlich sein, um ein erneutes Auftreten einer Hypoglykämie zu vermeiden.
oben
Dosierung und Anwendung
Levemir kann ein- oder zweimal täglich angewendet werden. Die Dosis von Levemir sollte gemäß den Blutzuckermessungen angepasst werden. Die Dosierung von Levemir sollte auf Anweisung des Arztes entsprechend den Bedürfnissen des Patienten individuell angepasst werden.
- Bei Patienten, die einmal täglich mit Levemir behandelt werden, sollte die Dosis zusammen mit dem Abendessen oder vor dem Schlafengehen verabreicht werden.
- Bei Patienten, die für eine wirksame Blutzuckerkontrolle eine zweimal tägliche Dosierung benötigen, kann die Abenddosis entweder mit dem Abendessen, vor dem Schlafengehen oder 12 Stunden nach der Morgendosis verabreicht werden.
Levemir sollte durch subkutane Injektion in den Oberschenkel, die Bauchdecke oder den Oberarm verabreicht werden. Die Injektionsstellen sollten innerhalb derselben Region gedreht werden. Wie bei allen Insulinen hängt die Wirkdauer von der Dosis, der Injektionsstelle, dem Blutfluss, der Temperatur und der körperlichen Aktivität ab.
Dosisbestimmung für Levemir
- Bei Patienten mit Typ-1- oder Typ-2-Diabetes, die mit Basalbolus behandelt werden, kann das Basalinsulin von Einheit zu Einheit auf Levemir umgestellt werden. Die Dosis von Levemir sollte dann angepasst werden, um glykämische Ziele zu erreichen. Bei einigen Patienten mit Typ-2-Diabetes ist möglicherweise mehr Levemir erforderlich als NPH-Insulin. In einer klinischen Studie betrug die mittlere Dosis am Ende der Behandlung 0,77 U / kg für Levemir und 0,52 IU / kg für NPH - Humaninsulin (vgl Tisch 3).
- Bei Patienten, die derzeit nur Basalinsulin erhalten, kann das Basalinsulin auf Levemir umgestellt werden.
- Bei insulinunabhängigen Patienten mit Typ-2-Diabetes, die unter unzureichender Kontrolle über orale Antidiabetika stehen, sollte Levemir angewendet werden bei einer Dosis von 0,1 bis 0,2 U / kg einmal täglich abends oder 10 Einheiten einmal oder zweimal täglich und der Dosis angepasst, um eine glykämische Wirkung zu erzielen Ziele.
- Wie bei allen Insulinen wird eine engmaschige Glukoseüberwachung während des Übergangs und in den ersten Wochen danach empfohlen. Dosis und Zeitpunkt der gleichzeitigen kurzwirksamen Insuline oder einer anderen gleichzeitigen Behandlung mit Antidiabetika müssen möglicherweise angepasst werden.
Vorbereitung und Handhabung
Levemir sollte vor der Verabreichung einer Sichtprüfung unterzogen werden und nur angewendet werden, wenn die Lösung klar und farblos erscheint.
Levemir darf nicht mit anderen Insulinpräparaten gemischt oder verdünnt werden.
Nach jeder Injektion muss der Patient die Nadel ohne Wiederverschluss entfernen und in einem durchstoßfesten Behälter entsorgen. Gebrauchte Spritzen, Nadeln oder Lanzetten sollten in "scharfen" Behältern (z. B. roter Biogefährdung) aufbewahrt werden Behälter), Hartplastikbehälter (z. B. Waschmittelflaschen) oder Metallbehälter (z. B. leere Flaschen) Kaffee kann). Solche Behälter sollten versiegelt und ordnungsgemäß entsorgt werden.
oben
Wie geliefert
Levemir ist in folgenden Packungsgrößen erhältlich: Jede Aufmachung enthält 100 Einheiten Insulindetemir pro ml (U-100).
| 10 ml Fläschchen | NDC 0169-3687-12 |
| 3 ml PenFill® Patronen * | NDC 0169-3305-11 |
| 3 ml InnoLet® | NDC 0169-2312-11 |
| 3 ml FlexPen® | NDC 0169-6439-10 |
* Levemir PenFill®-Patronen sind zur Verwendung mit Novo Nordisk 3-ml-PenFill®-Patronen-kompatiblen Insulinabgabegeräten und NovoFine®-Einwegnadeln vorgesehen.
Letzte Aktualisierung 05/2007
Levemir, Insulindetemir (rDNA-Ursprung), Patienteninformation (in reinem Englisch)
Detaillierte Informationen zu Anzeichen, Symptomen, Ursachen und Behandlungen von Diabetes
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
zurück zu: Durchsuchen Sie alle Medikamente für Diabetes


