Actos für Typ 2 Diabetes
Markenname: Actos
Generischer Name: Pioglitazonhydrochlorid
Inhalt:
Beschreibung
Pharmakologie
Indikationen und Verwendung
Kontraindikationen
Warnungen
Vorsichtsmaßnahmen
Nebenwirkungen
Überdosis
Dosierung und Anwendung
Wie geliefert
Actos, Pioglitazon hcl, Patienteninformation (in reinem Englisch)
WARNUNG: KONGESTIVE HERZSTÖRUNG
- Thiazolidindione, einschließlich Actos, verursachen oder verschlimmern bei einigen Patienten eine Herzinsuffizienz (vgl WARNUNGEN). Beobachten Sie nach der Einleitung von Actos und nach einer Dosiserhöhung die Patienten sorgfältig auf Anzeichen und Symptome einer Herzinsuffizienz (einschließlich übermäßiger, schneller Gewichtszunahme, Dyspnoe und / oder Ödeme). Wenn sich diese Anzeichen und Symptome entwickeln, sollte die Herzinsuffizienz gemäß den aktuellen Pflegestandards behandelt werden. Darüber hinaus muss ein Absetzen oder eine Dosisreduktion von Actos in Betracht gezogen werden.
- Actos wird bei Patienten mit symptomatischer Herzinsuffizienz nicht empfohlen. Die Einleitung von Actos bei Patienten mit bestehender Herzinsuffizienz der NYHA - Klasse III oder IV ist kontraindiziert (siehe Abschnitt 4.4) KONTRAINDIKATIONEN und WARNUNGEN).
Beschreibung
Actos (Pioglitazonhydrochlorid) ist ein orales Antidiabetikum, das in erster Linie die Insulinresistenz senkt. Actos wird zur Behandlung von Diabetes mellitus Typ 2 (auch als nicht insulinabhängiger Diabetes mellitus [NIDDM] oder Diabetes bei Erwachsenen bekannt) angewendet. Pharmakologische Studien zeigen, dass Actos die Empfindlichkeit gegenüber Insulin in Muskel- und Fettgewebe verbessert und die Glukoneogenese in der Leber hemmt. Actos verbessert die Blutzuckerkontrolle und senkt gleichzeitig den Insulinspiegel.
Pioglitazon [(±) -5 - [[4- [2- (5-Ethyl-2-pyridinyl) ethoxy] phenyl] methyl] -2,4-] thiazolidindionmonohydrochlorid gehört zu a unterschiedliche chemische Klasse und hat eine andere pharmakologische Wirkung als die Sulfonylharnstoffe, Metformin oder die α-Glucosidase Inhibitoren. Das Molekül enthält einen asymmetrischen Kohlenstoff und die Verbindung wird synthetisiert und als racemisches Gemisch verwendet. Die beiden Enantiomere von Pioglitazon wandeln sich in vivo um. Es wurden keine Unterschiede in der pharmakologischen Aktivität zwischen den beiden Enantiomeren gefunden. Die Strukturformel lautet wie folgt:
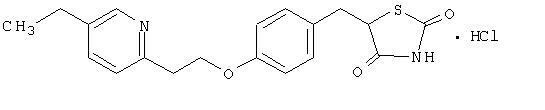
Pioglitazonhydrochlorid ist ein geruchloses weißes kristallines Pulver mit der Summenformel C19H20N2Ö3S-HCl und ein Molekulargewicht von 392,90 Dalton. Es ist löslich in N, N-Dimethylformamid, leicht löslich in wasserfreiem Ethanol, sehr schwer löslich in Aceton und Acetonitril, praktisch unlöslich in Wasser und unlöslich in Ether.
Actos ist als Tablette zur oralen Verabreichung erhältlich, die 15 mg, 30 mg oder 45 mg Pioglitazon (als Basis) enthält die folgenden sonstigen Bestandteile: Lactose Monohydrat NF, Hydroxypropylcellulose NF, Carboxymethylcellulose Calcium NF und Magnesiumstearat NF.
oben
Klinische Pharmakologie
Wirkmechanismus
Actos ist ein Thiazolidindion-Antidiabetikum, dessen Wirkungsmechanismus von der Anwesenheit von Insulin abhängt. Actos senkt die Insulinresistenz in der Peripherie und in der Leber, was zu einer erhöhten insulinabhängigen Glukoseabgabe und einer verringerten Glukoseabgabe in der Leber führt. Im Gegensatz zu Sulfonylharnstoffen ist Pioglitazon kein Insulinsekretagogum. Pioglitazon ist ein starker Agonist für Peroxisom-Proliferator-aktivierten Rezeptor-Gamma (PPAR³). PPAR-Rezeptoren finden sich in für die Insulinwirkung wichtigen Geweben wie Fettgewebe, Skelettmuskel und Leber. Die Aktivierung von PPAR³-Kernrezeptoren moduliert die Transkription einer Reihe von auf Insulin ansprechenden Genen, die an der Steuerung des Glukose- und Lipidstoffwechsels beteiligt sind.
In Tiermodellen für Diabetes reduziert Pioglitazon die Hyperglykämie, Hyperinsulinämie und Hypertriglyceridämie, die für insulinresistente Zustände wie Typ-2-Diabetes charakteristisch sind. Die durch Pioglitazon verursachten Stoffwechselveränderungen führen zu einer erhöhten Empfindlichkeit von insulinabhängigen Geweben und werden in zahlreichen Tiermodellen der Insulinresistenz beobachtet.
Da Pioglitazon die Wirkung des zirkulierenden Insulins verstärkt (indem es die Insulinresistenz senkt), senkt es den Blutzucker in Tiermodellen, denen endogenes Insulin fehlt, nicht.
Pharmakokinetik und Arzneimittelstoffwechsel
Die Serumkonzentrationen von Gesamt-Pioglitazon (Pioglitazon plus aktive Metaboliten) bleiben 24 Stunden nach einmal täglicher Gabe erhöht. Steady-State-Serumkonzentrationen von Pioglitazon und Gesamt-Pioglitazon werden innerhalb von 7 Tagen erreicht. Im Steady-State erreichen zwei der pharmakologisch aktiven Metaboliten von Pioglitazon, Metaboliten III (M-III) und IV (M-IV), Serumkonzentrationen, die gleich oder größer als Pioglitazon sind. Sowohl bei gesunden Probanden als auch bei Patienten mit Typ-2-Diabetes macht Pioglitazon etwa 30% bis 50% der Gesamtmenge aus Peak-Gesamt-Pioglitazon-Serumkonzentrationen und 20% bis 25% der Gesamtfläche unter der Serumkonzentrations-Zeit-Kurve (AUC).
Maximale Serumkonzentration (Cmax), AUC und durch Serumkonzentrationen (CMindest) sowohl für Pioglitazon als auch für Gesamt-Pioglitazon steigen proportional bei Dosierungen von 15 mg und 30 mg pro Tag an. Bei einer Dosis von 60 mg pro Tag ist ein geringfügig unterproportionaler Anstieg von Pioglitazon und Gesamt-Pioglitazon zu verzeichnen.
Resorption: Nach oraler Verabreichung ist Pioglitazon im nüchternen Zustand erstmals innerhalb von 30 Minuten im Serum messbar, wobei Spitzenkonzentrationen innerhalb von 2 Stunden beobachtet werden. Das Essen verzögert die Zeit bis zum Erreichen der maximalen Serumkonzentration geringfügig auf 3 bis 4 Stunden, verändert jedoch nicht das Ausmaß der Resorption.
Verteilung: Das mittlere scheinbare Verteilungsvolumen (Vd / F) von Pioglitazon nach einmaliger Verabreichung beträgt 0,63 ± 0,41 (Mittelwert ± SD) L / kg Körpergewicht.
Pioglitazon ist im menschlichen Serum weitgehend an Proteine gebunden (> 99%), hauptsächlich an Serumalbumin. Pioglitazon bindet auch an andere Serumproteine, jedoch mit geringerer Affinität. Die Metaboliten M-III und M-IV sind ebenfalls weitgehend (> 98%) an Serumalbumin gebunden.
Metabolismus: Pioglitazon wird durch Hydroxylierung und Oxidation weitgehend metabolisiert. Die Metaboliten wandeln sich auch teilweise in Glucuronid- oder Sulfatkonjugate um. Die Metaboliten M-II und M-IV (Hydroxyderivate von Pioglitazon) und M-III (Ketoderivat von Pioglitazon) sind in Tiermodellen für Typ-2-Diabetes pharmakologisch aktiv. Neben Pioglitazon sind M-III und M-IV die wichtigsten arzneimittelbezogenen Spezies, die nach Mehrfachgabe im menschlichen Serum vorkommen. Im Steady-State, sowohl bei gesunden Probanden als auch bei Patienten mit Typ-2-Diabetes, Pioglitazon umfasst ungefähr 30% bis 50% der gesamten Serumspitzenkonzentrationen und 20% bis 25% der Serumspitzenkonzentrationen AUC gesamt
In-vitro-Daten zeigen, dass mehrere CYP-Isoformen am Metabolismus von Pioglitazon beteiligt sind. Bei den beteiligten Cytochrom P450-Isoformen handelt es sich um CYP2C8 und in geringerem Maße um CYP3A4 mit zusätzlichen Beiträgen aus einer Reihe anderer Isoformen, einschließlich des hauptsächlich extrahepatischen CYP1A1. In - vivo - Studien zu Pioglitazon in Kombination mit P450 - Inhibitoren und - Substraten wurden durchgeführt (vgl Wechselwirkungen mit anderen Medikamenten). Das Verhältnis 6ß-Hydroxycortisol / Cortisol im Urin, das bei mit Actos behandelten Patienten gemessen wurde, zeigte, dass Pioglitazon kein starker CYP3A4-Enzyminduktor ist.
Ausscheidung und Elimination: Nach oraler Verabreichung werden ungefähr 15% bis 30% der Pioglitazon-Dosis im Urin wiedergewonnen. Die renale Elimination von Pioglitazon ist vernachlässigbar und das Arzneimittel wird hauptsächlich als Metaboliten und deren Konjugate ausgeschieden. Es wird vermutet, dass der größte Teil der oralen Dosis unverändert oder als Metaboliten in die Galle ausgeschieden und über den Kot ausgeschieden wird.
Die mittlere Serumhalbwertszeit von Pioglitazon und Gesamt-Pioglitazon liegt zwischen 3 und 7 Stunden bzw. zwischen 16 und 24 Stunden. Pioglitazon hat eine scheinbare Clearance, CL / F, die mit 5 bis 7 l / h berechnet wurde.
Besondere Bevölkerungsgruppen
Niereninsuffizienz: Die Serumeliminationshalbwertszeit von Pioglitazon, M-III und M-IV bleibt bei Patienten mit mäßigen Werten unverändert (Kreatinin-Clearance 30 bis 60 ml / min) bis schwere (Kreatinin-Clearance <30 ml / min) Nierenfunktionsstörung im Vergleich zu normal Themen. Es wird keine Dosisanpassung bei Patienten mit Nierenfunktionsstörung empfohlen (siehe DOSIERUNG UND ANWENDUNG).
Leberinsuffizienz: Im Vergleich zu normalen Kontrollen haben Personen mit eingeschränkter Leberfunktion (Child-Pugh-Grad B / C) eine Ca. 45% Reduktion der mittleren Pioglitazon- und Gesamt-Pioglitazon-Spitzenkonzentrationen, aber keine Änderung der mittleren AUC Werte.
Die Actos-Therapie sollte nicht eingeleitet werden, wenn der Patient klinische Hinweise auf eine aktive Lebererkrankung oder Serumtransaminasespiegel (ALT) aufweist, die das 2,5-fache der Obergrenze des Normalwerts überschreiten (siehe VORSICHTSMASSNAHMEN, Hepatische Effekte).
Ältere Patienten: Bei gesunden älteren Patienten sind die Serumspitzenkonzentrationen von Pioglitazon und Gesamt-Pioglitazon nicht gegeben signifikant unterschiedlich, aber die AUC-Werte sind etwas höher und die Werte der terminalen Halbwertszeit etwas länger als für jüngere Fächer. Diese Veränderungen waren nicht von einer Größenordnung, die als klinisch relevant angesehen werden würde.
Pädiatrie: Pharmakokinetische Daten zur pädiatrischen Population liegen nicht vor.
Geschlecht: Der Mittelwert Cmax und AUC-Werte waren bei Frauen um 20% bis 60% erhöht. Als Monotherapie und in Kombination mit Sulfonylharnstoff, Metformin oder Insulin verbesserte Actos die Blutzuckerkontrolle bei Männern und Frauen. In kontrollierten klinischen Studien wurde Hämoglobin A1c (HbA1c) waren die Abnahmen gegenüber dem Ausgangswert bei Frauen im Allgemeinen größer als bei Männern (durchschnittlicher mittlerer Unterschied in HbA)1c 0.5%). Da die Therapie für jeden Patienten individuell angepasst werden sollte, um eine Blutzuckerkontrolle zu erreichen, wird keine Dosisanpassung allein aufgrund des Geschlechts empfohlen.
Ethnizität: Pharmakokinetische Daten für verschiedene ethnische Gruppen sind nicht verfügbar.
Arzneimittel-Wechselwirkungen
Die folgenden Arzneimittel wurden an gesunden Probanden unter gleichzeitiger Anwendung von Actos 45 mg einmal täglich untersucht. Nachfolgend sind die Ergebnisse aufgeführt:
Orale Kontrazeptiva: Die gleichzeitige Anwendung von Actos (45 mg einmal täglich) und einem oralen Kontrazeptivum (1 mg Norethindron plus) 0,035 mg Ethinylestradiol einmal täglich über einen Zeitraum von 21 Tagen führten zu einer Verringerung der AUC von Ethinylestradiol um 11% und 11 bis 14% (0 bis 24 Stunden). und Cmax beziehungsweise. Es gab keine signifikanten Veränderungen bei der Norethindron-AUC (0-24h) und Cmax. Angesichts der hohen Variabilität der Pharmakokinetik von Ethinylestradiol ist die klinische Bedeutung dieses Befundes nicht bekannt.
Fexofenadin HCl: Die gleichzeitige Anwendung von Actos über 7 Tage mit 60 mg Fexofenadin, das zweimal täglich oral verabreicht wurde, führte zu keiner signifikanten Wirkung auf die Pharmakokinetik von Pioglitazon. Actos hatte keinen signifikanten Einfluss auf die Pharmakokinetik von Fexofenadin.
Glipizid: Die gleichzeitige Anwendung von Actos und 5 mg Glipizid, die einmal täglich über einen Zeitraum von 7 Tagen oral verabreicht wurden, änderte die Steady-State-Pharmakokinetik von Glipizid nicht.
Digoxin: Die gleichzeitige Anwendung von Actos mit 0,25 mg Digoxin, das über einen Zeitraum von 7 Tagen einmal täglich oral verabreicht wurde, änderte die Steady-State-Pharmakokinetik von Digoxin nicht.
Warfarin: Die gleichzeitige Anwendung von Actos über einen Zeitraum von 7 Tagen mit Warfarin hat die Pharmakokinetik von Warfarin im Steady-State nicht verändert. Actos hat keine klinisch signifikante Wirkung auf die Prothrombinzeit, wenn es Patienten verabreicht wird, die eine chronische Warfarin-Therapie erhalten.
Metformin: Die gleichzeitige Anwendung einer Einzeldosis von Metformin (1000 mg) und Actos nach 7 Tagen Actos änderte die Pharmakokinetik der Einzeldosis von Metformin nicht.
Midazolam: Die Verabreichung von Actos über 15 Tage, gefolgt von einer einzelnen Dosis von 7,5 mg Midazolam-Sirup, führte zu einer Verringerung von Midazolam C um 26%max und AUC.
Ranitidin-HCl: Die gleichzeitige Anwendung von Actos über 7 Tage mit Ranitidin, das entweder 4 oder 7 Tage lang zweimal täglich oral verabreicht wurde, führte zu keiner signifikanten Wirkung auf die Pharmakokinetik von Pioglitazon. Actos zeigte keinen signifikanten Effekt auf die Pharmakokinetik von Ranitidin.
Nifedipin ER: Die gleichzeitige Anwendung von Actos über einen Zeitraum von 7 Tagen mit 30 mg Nifedipin ER, das über einen Zeitraum von 4 Tagen einmal täglich oral verabreicht wird männliche und weibliche Freiwillige ergaben für unverändertes Nifedipin einen kleinsten quadratischen Mittelwert (90% CI) von 0,83 (0,73 - 0,95) für Cmax und 0,88 (0,80 - 0,96) für AUC. Angesichts der hohen Variabilität der Pharmakokinetik von Nifedipin ist die klinische Bedeutung dieses Befundes nicht bekannt.
Ketoconazol: Actos wird 7 Tage lang zusammen mit 200 mg Ketoconazol zweimal verabreicht täglich ergaben sich für unverändertes Pioglitazon Mittelwerte der kleinsten Quadrate (90% CI) von 1,14 (1,06 - 1,23) für Cmax1,34 (1,26 - 1,41) für AUC und 1,87 (1,71 - 2,04) für CMindest.
Atorvastatin Calcium: Die gleichzeitige Anwendung von Actos über 7 Tage mit Atorvastatin Calcium (LIPITOR®) 80 mg einmal täglich ergaben sich für unverändertes Pioglitazon Mittelwerte der kleinsten Quadrate (90% CI) von 0,69 (0,57 - 0,85) für Cmax0,76 (0,65 - 0,88) für AUC und 0,96 (0,87 - 1,05) für CMindest. Für unverändertes Atorvastatin betrug der kleinste quadratische Mittelwert (90% CI) für C 0,77 (0,66 - 0,90)max0,86 (0,78 - 0,94) für AUC und 0,92 (0,82 - 1,02) für CMindest.
Theophyllin: Die gleichzeitige Anwendung von Actos über 7 Tage mit Theophyllin 400 mg, das zweimal täglich verabreicht wurde, führte zu keiner Änderung der Pharmakokinetik der beiden Arzneimittel.
Cytochrom P450: Siehe VORSICHTSMASSNAHMEN
Gemfibrozil: Die gleichzeitige Anwendung von Gemfibrozil (600 mg oral zweimal täglich), einem CYP2C8-Hemmer, mit Pioglitazon (30 mg oral) bei 10 vorbehandelten gesunden Probanden für 2 Tage vor mit Gemfibrozil (oral 600 mg zweimal täglich) führte zu einer Pioglitazon-Exposition (AUC0-24) von 226% der Pioglitazon-Exposition in Abwesenheit von Gemfibrozil (sehen VORSICHTSMASSNAHMEN).
Rifampin: Gleichzeitige Anwendung von Rifampin (600 mg einmal täglich oral), einem Induktor von CYP2C8 mit Pioglitazon (30 mg oral), bei 10 Gesunden Freiwillige, die 5 Tage zuvor mit Rifampin (600 mg einmal täglich oral) vorbehandelt worden waren, führten zu einer Verringerung der AUC von Pioglitazon um 54% (siehe VORSICHTSMASSNAHMEN).
Pharmakodynamik und klinische Effekte
Klinische Studien zeigen, dass Actos die Insulinsensitivität bei insulinresistenten Patienten verbessert. Actos verbessert die zelluläre Reaktion auf Insulin, erhöht die insulinabhängige Glukoseentsorgung, verbessert die Empfindlichkeit der Leber gegenüber Insulin und verbessert die gestörte Glukosehomöostase. Bei Patienten mit Typ-2-Diabetes führt die von Actos verursachte verminderte Insulinresistenz zu niedrigeren Plasmaglucosekonzentrationen, niedrigeren Plasmainsulinspiegeln und niedrigerem HbA1c Werte. Basierend auf Ergebnissen einer Open-Label-Verlängerungsstudie scheinen die glukoseabsenkenden Wirkungen von Actos für mindestens ein Jahr bestehen zu bleiben. In kontrollierten klinischen Studien wirkte sich Actos in Kombination mit Sulfonylharnstoff, Metformin oder Insulin additiv auf die Blutzuckerkontrolle aus.
Patienten mit Lipidanomalien wurden in klinische Studien mit Actos eingeschlossen. Insgesamt hatten mit Actos behandelte Patienten eine mittlere Abnahme der Triglyceride, eine mittlere Zunahme des HDL-Cholesterins und keine konsistenten mittleren Veränderungen des LDL und des Gesamtcholesterins.
In einer 26-wöchigen, placebokontrollierten, dosisabhängigen Studie sanken die mittleren Triglyceridspiegel in den Actos-Dosisgruppen 15 mg, 30 mg und 45 mg im Vergleich zu einem mittleren Anstieg der Placebogruppe. Die mittleren HDL-Spiegel stiegen bei mit Actos behandelten Patienten stärker an als bei mit Placebo behandelten Patienten. Es gab keine konsistenten Unterschiede für LDL und Gesamtcholesterin bei mit Actos behandelten Patienten im Vergleich zu Placebo (Tabelle 1).
Tabelle 1 Lipide in einer 26-wöchigen placebokontrollierten Monotherapie-Dosisbereichsstudie
| Placebo | Actos 15 mg Einmal Täglich |
Actos 30 mg Einmal Täglich |
Actos 45 mg Einmal Täglich |
|
| Triglyceride (mg / dl) | N = 79 | N = 79 | N = 84 | N = 77 |
| Grundlinie (Mittelwert) | 262.8 | 283.8 | 261.1 | 259.7 |
| Prozentuale Veränderung gegenüber dem Ausgangswert (Mittelwert) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL-Cholesterin (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Grundlinie (Mittelwert) | 41.7 | 40.4 | 40.8 | 40.7 |
| Prozentuale Veränderung gegenüber dem Ausgangswert (Mittelwert) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL-Cholesterin (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Grundlinie (Mittelwert) | 138.8 | 131.9 | 135.6 | 126.8 |
| Prozentuale Veränderung gegenüber dem Ausgangswert (Mittelwert) | 4.8% | 7.2% | 5.2% | 6.0% |
| Gesamtcholesterin (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Grundlinie (Mittelwert) | 224.6 | 220.0 | 222.7 | 213.7 |
| Prozentuale Veränderung gegenüber dem Ausgangswert (Mittelwert) | 4.4% | 4.6% | 3.3% | 6.4% |
In den beiden anderen Monotherapie-Studien (24 Wochen und 16 Wochen) und in Kombinationstherapie-Studien mit Sulfonylharnstoff (24 Wochen und 16 Wochen) und Metformin (24 Wochen und 16 Wochen) stimmten die Ergebnisse im Allgemeinen mit den Daten überein über. In placebokontrollierten Studien sanken die placebokorrigierten mittleren Veränderungen gegenüber dem Ausgangswert bei Triglyceriden um 5% auf 26% und bei HDL-Patienten, die mit Actos behandelt wurden, um 6% auf 13%. Ein ähnliches Ergebnismuster wurde in 24-wöchigen Kombinationsstudien von Actos mit Sulfonylharnstoff oder Metformin beobachtet.
In einer Kombinationstherapiestudie mit Insulin (16 Wochen) war auch die placebokorrigierte mittlere prozentuale Veränderung der Triglyceridwerte bei mit Actos behandelten Patienten gegenüber dem Ausgangswert verringert. Eine placebokorrigierte mittlere Änderung des LDL-Cholesterins gegenüber dem Ausgangswert von 7% wurde für die 15 mg-Dosisgruppe beobachtet. Es wurden ähnliche Ergebnisse wie oben für HDL und Gesamtcholesterin festgestellt. Ein ähnliches Ergebnismuster wurde in einer 24-wöchigen Kombinationstherapie-Studie mit Actos mit Insulin beobachtet.
Klinische Studien
Monotherapie
In den USA wurden drei randomisierte, doppelblinde, placebokontrollierte Studien mit einer Dauer von 16 bis 26 Wochen durchgeführt, um die Anwendung von Actos als Monotherapie bei Patienten mit Typ-2-Diabetes zu bewerten. In diesen Studien wurde Actos in Dosen von bis zu 45 mg oder Placebo einmal täglich bei 865 Patienten untersucht.
In einer 26-wöchigen, dosisabhängigen Studie wurden 408 Patienten mit Typ-2-Diabetes randomisiert und erhielten einmal täglich 7,5 mg, 15 mg, 30 mg oder 45 mg Actos oder Placebo. Die Therapie mit einem früheren Antidiabetikum wurde 8 Wochen vor der Doppelblindperiode abgebrochen. Die Behandlung mit 15 mg, 30 mg und 45 mg Actos führte zu statistisch signifikanten Verbesserungen von HbA1c und Nüchternplasmaglucose (FPG) am Endpunkt im Vergleich zu Placebo (Abbildung 1, Tabelle 2).
Abbildung 1 zeigt den zeitlichen Verlauf der FPG- und HbA1c-Veränderungen für die gesamte Studienpopulation in dieser 26-wöchigen Studie.
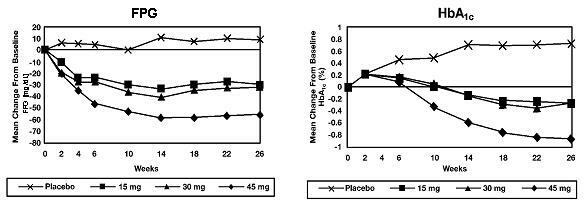
Tabelle 2 zeigt HbA1c und FPG-Werte für die gesamte Studienpopulation.
Tabelle 2 Glykämische Parameter in einer 26-wöchigen placebokontrollierten Dosisbereichsstudie
| Placebo | Actos 15 mg Einmal Täglich |
Actos 30 mg Einmal Täglich |
Actos 45 mg Einmal Täglich |
|
| BEVÖLKERUNG INSGESAMT | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Grundlinie (Mittelwert) | 10.4 | 10.2 | 10.2 | 10.3 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Differenz zum Placebo (bereinigter Mittelwert)+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dl) | N = 79 | N = 79 | N = 84 | N = 77 |
| Grundlinie (Mittelwert) | 268 | 267 | 269 | 276 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)+) | 9 | -30 | -32 | -56 |
| Differenz zum Placebo (bereinigter Mittelwert)+) | -39* | -41* | -65* | |
|
+ Bereinigt um Basislinie, gepooltes Zentrum und gepooltes Zentrum durch Interaktion mit der Behandlung * p ¤ 0,050 vs. Placebo |
Die Studienpopulation umfasste Patienten, die zuvor nicht mit Antidiabetika behandelt wurden (naiv; 31%) und Patienten, die zum Zeitpunkt der Studienaufnahme Antidiabetika erhielten (zuvor behandelt); 69%). Die Daten für die naiven und zuvor behandelten Patientenuntergruppen sind in Tabelle 3 gezeigt. Alle Patienten hatten vor der Doppelblindbehandlung eine 8-wöchige Auswasch- / Einlaufphase. Diese Einlaufzeit war mit einer geringen Veränderung des HbA verbunden1c und FPG-Werte vom Screening bis zum Ausgangswert für die naiven Patienten; Bei der zuvor behandelten Gruppe führte das Auswaschen von früheren Antidiabetika zu einer Verschlechterung der Blutzuckerkontrolle und einem Anstieg des HbA1c und FPG. Obwohl die meisten Patienten in der zuvor behandelten Gruppe eine Abnahme der HbA gegenüber dem Ausgangswert aufwiesen1c und FPG mit Actos erreichten die Werte zum Ende der Studie in vielen Fällen nicht wieder die Screening-Werte. Das Studiendesign erlaubte keine Bewertung von Patienten, die von einem anderen Antidiabetikum direkt zu Actos wechselten.
Tabelle 3 Glykämische Parameter in einer 26-wöchigen placebokontrollierten Dosisbereichsstudie
| Placebo | Actos 15 mg Einmal Täglich |
Actos 30 mg Einmal Täglich |
Actos 45 mg Einmal Täglich |
|
| Naiv zur Therapie HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (Mittelwert) | 9.3 | 10.0 | 9.5 | 9.8 |
| Grundlinie (Mittelwert) | 9.0 | 9.9 | 9.3 | 10.0 |
| Veränderung von der Basislinie (bereinigter Mittelwert *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Differenz zum Placebo (bereinigter Mittelwert *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dl) | N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (Mittelwert) | 223 | 245 | 239 | 239 |
| Grundlinie (Mittelwert) | 229 | 251 | 225 | 235 |
| Veränderung von der Basislinie (bereinigter Mittelwert *) | 16 | -37 | -41 | -64 |
| Differenz zum Placebo (bereinigter Mittelwert *) | -52 | -56 | -80 | |
| Zuvor behandelt HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Screening (Mittelwert) | 9.3 | 9.0 | 9.1 | 9.0 |
| Grundlinie (Mittelwert) | 10.9 | 10.4 | 10.4 | 10.6 |
| Veränderung von der Basislinie (bereinigter Mittelwert *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Differenz zum Placebo (bereinigter Mittelwert *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dl) | N = 54 | N = 53 | N = 58 | N = 56 |
| Screening (Mittelwert) | 222 | 209 | 230 | 215 |
| Grundlinie (Mittelwert) | 285 | 275 | 286 | 292 |
| Veränderung von der Basislinie (bereinigter Mittelwert *) | 4 | -32 | -27 | -55 |
| Differenz zum Placebo (bereinigter Mittelwert *) | -36 | -31 | -59 | |
| * Bereinigt um Basislinie und gepoolte Mitte |
In einer 24-wöchigen, placebokontrollierten Studie wurden 260 Patienten mit Typ-2-Diabetes in eine von zwei Zwangstitrations-Actos-Behandlungsgruppen oder eine Scheintitrations-Placebogruppe randomisiert. Die Therapie mit einem früheren Antidiabetikum wurde 6 Wochen vor der Doppelblindperiode abgebrochen. In einer Actos-Behandlungsgruppe erhielten die Patienten eine Anfangsdosis von 7,5 mg einmal täglich. Nach vier Wochen wurde die Dosis einmal täglich auf 15 mg erhöht, und nach weiteren vier Wochen wurde die Dosis für den Rest der Studie (16 Wochen) einmal täglich auf 30 mg erhöht. In der zweiten Actos-Behandlungsgruppe erhielten die Patienten eine Anfangsdosis von 15 mg einmal täglich und wurden auf ähnliche Weise auf 30 mg einmal täglich und 45 mg einmal täglich titriert. Die beschriebene Behandlung mit Actos führte zu statistisch signifikanten Verbesserungen der HbA1c und FPG am Endpunkt im Vergleich zu Placebo (Tabelle 4).
Tabelle 4 Glykämische Parameter in einer 24-wöchigen placebokontrollierten Zwangstitrationsstudie
| Placebo | Actos 30 mg+ Einmal täglich |
Actos 45 mg+ Einmal täglich |
|
| Gesamtbevölkerung HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Grundlinie (Mittelwert) | 10.8 | 10.3 | 10.8 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)++) | 0.9 | -0.6 | -0.6 |
| Differenz zum Placebo (bereinigter Mittelwert)++) | -1.5* | -1.5* | |
| FPG (mg / dl) | N = 78 | N = 82 | N = 85 |
| Grundlinie (Mittelwert) | 279 | 268 | 281 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)++) | 18 | -44 | -50 |
| Differenz zum Placebo (bereinigter Mittelwert)++) | -62* | -68* | |
|
+ Enddosis bei forcierter Titration ++ Bereinigt um Basislinie, gepooltes Zentrum und gepooltes Zentrum durch Interaktion mit der Behandlung * p ¤ 0,050 vs. Placebo |
Für Patienten, die zuvor nicht mit Antidiabetika behandelt worden waren (24%), lagen die Mittelwerte beim Screening für HbA bei 10,1%1c und 238 mg / dl für FPG. Zu Studienbeginn mittlere HbA1c betrug 10,2% und der mittlere FPG betrug 243 mg / dl. Im Vergleich zu Placebo führte die Behandlung mit Actos, das auf eine Enddosis von 30 mg und 45 mg titriert wurde, zu einer Verringerung des mittleren HbA gegenüber dem Ausgangswert1c von 2,3% und 2,6% und einem mittleren FPG von 63 mg / dL bzw. 95 mg / dL. Bei Patienten, die zuvor mit Antidiabetika behandelt worden waren (76%), wurde dieses Medikament beim Screening abgesetzt. Die Mittelwerte beim Screening betrugen 9,4% für HbA1c und 216 mg / dl für FPG. Zu Studienbeginn mittlere HbA1c betrug 10,7% und das mittlere FPG betrug 290 mg / dl. Im Vergleich zu Placebo führte die Behandlung mit Actos, das auf eine Enddosis von 30 mg und 45 mg titriert wurde, zu einer Verringerung des mittleren HbA gegenüber dem Ausgangswert1c von 1,3% bzw. 1,4% und ein mittlerer FPG von 55 mg / dL bzw. 60 mg / dL. Für viele zuvor behandelte Patienten ist HbA1c und FPG war bis zum Ende der Studie nicht auf das Screening-Niveau zurückgekehrt.
In einer 16-wöchigen Studie wurden 197 Patienten mit Typ-2-Diabetes randomisiert und einmal täglich mit 30 mg Actos oder Placebo behandelt. Die Therapie mit einem früheren Antidiabetikum wurde 6 Wochen vor der Doppelblindperiode abgebrochen. Die Behandlung mit 30 mg Actos führte zu statistisch signifikanten Verbesserungen der HbA1c und FPG am Endpunkt im Vergleich zu Placebo (Tabelle 5).
Tabelle 5 Glykämische Parameter in einer 16-wöchigen placebokontrollierten Studie
| Placebo | Actos 30 mg Einmal täglich |
|
| Gesamtbevölkerung HbA1c (%) |
N = 93 | N = 100 |
| Grundlinie (Mittelwert) | 10.3 | 10.5 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)+) | 0.8 | -0.6 |
| Differenz zum Placebo (bereinigter Mittelwert)+) | -1.4* | |
| FPG (mg / dl) | N = 91 | N = 99 |
| Grundlinie (Mittelwert) | 270 | 273 |
| Veränderung gegenüber dem Ausgangswert (bereinigter Mittelwert)+) | 8 | -50 |
| Differenz zum Placebo (bereinigter Mittelwert)+) | -58* | |
|
+ Bereinigt um Basislinie, gepooltes Zentrum und gepooltes Zentrum durch Interaktion mit der Behandlung * p ¤ 0,050 vs. Placebo |
Für Patienten, die zuvor nicht mit Antidiabetika behandelt worden waren (40%), lagen die Mittelwerte beim Screening für HbA1c bei 10,3% und für FPG bei 240 mg / dL. Zu Studienbeginn mittlere HbA1c betrug 10,4% und das mittlere FPG betrug 254 mg / dl. Im Vergleich zu Placebo führte die Behandlung mit Actos 30 mg zu einer Verringerung des mittleren HbA gegenüber dem Ausgangswert1c von 1,0% und einem mittleren FPG von 62 mg / dl. Bei Patienten, die zuvor mit Antidiabetika (60%) behandelt worden waren, wurde dieses Medikament beim Screening abgesetzt. Die Mittelwerte beim Screening betrugen 9,4% für HbA1c und 216 mg / dl für FPG. Zu Studienbeginn mittlere HbA1c betrug 10,6% und das mittlere FPG betrug 287 mg / dl. Im Vergleich zu Placebo führte die Behandlung mit Actos 30 mg zu einer Verringerung des mittleren HbA gegenüber dem Ausgangswert1c von 1,3% und einem mittleren FPG von 46 mg / dl. Für viele zuvor behandelte Patienten ist HbA1c und FPG war bis zum Ende der Studie nicht auf das Screening-Niveau zurückgekehrt.
Kombinationstherapie
Drei 16-wöchige randomisierte, doppelblinde, placebokontrollierte klinische Studien und drei 24-wöchige randomisierte, doppelblinde, dosiskontrollierte Studien Es wurden klinische Studien durchgeführt, um die Auswirkungen von Actos auf die Blutzuckerkontrolle bei Patienten mit Typ-2-Diabetes zu bewerten, die nicht ausreichend waren kontrolliert (HbA1c 8%) trotz aktueller Therapie mit einem Sulfonylharnstoff, Metformin oder Insulin. Bisherige Diabetesbehandlungen waren möglicherweise Monotherapie oder Kombinationstherapie.
Actos Plus Sulfonylharnstoff-Studien
Zwei klinische Studien wurden mit Actos in Kombination mit einem Sulfonylharnstoff durchgeführt. Beide Studien umfassten Patienten mit Typ-2-Diabetes, die entweder allein oder in Kombination mit einem anderen Antidiabetikum einen Sulfonylharnstoff erhielten. Alle anderen Antidiabetika wurden vor Beginn der Studienbehandlung abgesetzt. In der ersten Studie wurden 560 Patienten randomisiert und erhielten zusätzlich zu ihrem derzeitigen Sulfonylharnstoff-Regime 16 Wochen lang einmal täglich 15 mg oder 30 mg Actos oder Placebo. Im Vergleich zu Placebo in Woche 16 verringerte die Zugabe von Actos zum Sulfonylharnstoff den mittleren HbA-Wert signifikant1c um 0,9% und 1,3% und mittleres FPG um 39 mg / dl und 58 mg / dl für die 15 mg- bzw. 30 mg-Dosen.
In der zweiten Studie wurden 702 Patienten randomisiert und erhielten 24 Wochen lang einmal täglich 30 mg oder 45 mg Actos zusätzlich zu ihrem derzeitigen Sulfonylharnstoff-Regime. Die mittleren Verringerungen gegenüber dem Ausgangswert in Woche 24 in HbA1c waren 1,55% und 1,67% für die 30 mg bzw. 45 mg-Dosen. Die mittleren Verringerungen gegenüber dem Ausgangswert in FPG betrugen 51,5 mg / dl und 56,1 mg / dl.
Die therapeutische Wirkung von Actos in Kombination mit Sulfonylharnstoff wurde bei Patienten beobachtet, unabhängig davon, ob die Patienten niedrige, mittlere oder hohe Dosen Sulfonylharnstoff erhielten.
Actos Plus Metformin Studien
Zwei klinische Studien wurden mit Actos in Kombination mit Metformin durchgeführt. Beide Studien umfassten Patienten mit Typ-2-Diabetes unter Metformin, entweder allein oder in Kombination mit einem anderen Antidiabetikum. Alle anderen Antidiabetika wurden vor Beginn der Studienbehandlung abgesetzt. In der ersten Studie wurden 328 Patienten randomisiert und erhielten zusätzlich zu ihrem derzeitigen Metformin-Regime 16 Wochen lang einmal täglich 30 mg Actos oder Placebo. Im Vergleich zu Placebo in Woche 16 verringerte die Zugabe von Actos zu Metformin den mittleren HbA-Wert signifikant1c um 0,8% und verringerte das mittlere FPG um 38 mg / dl.
In der zweiten Studie wurden 827 Patienten randomisiert und erhielten 24 Wochen lang entweder 30 mg oder 45 mg Actos einmal täglich zusätzlich zu ihrem derzeitigen Metformin-Schema. Die mittleren Verringerungen gegenüber dem Ausgangswert in Woche 24 in HbA1c waren 0,80% und 1,01% für die 30 mg bzw. 45 mg-Dosen. Die mittleren Verringerungen gegenüber dem Ausgangswert in FPG betrugen 38,2 mg / dl und 50,7 mg / dl.
Die therapeutische Wirkung von Actos in Kombination mit Metformin wurde bei Patienten beobachtet, unabhängig davon, ob die Patienten niedrigere oder höhere Dosen von Metformin erhielten.
Actos Plus Insulinstudien
Zwei klinische Studien wurden mit Actos in Kombination mit Insulin durchgeführt. Beide Studien umfassten Patienten mit Typ-2-Diabetes unter Insulin, entweder allein oder in Kombination mit einem anderen Antidiabetikum. Alle anderen Antidiabetika wurden vor Beginn der Studienbehandlung abgesetzt. In der ersten Studie wurden 566 Patienten, die einen Median von 60,5 Einheiten Insulin pro Tag erhielten, randomisiert Sie erhalten 16 Wochen lang einmal täglich 15 mg oder 30 mg Actos oder Placebo zusätzlich zu ihrem Insulin Regime. Im Vergleich zu Placebo in Woche 16 reduzierte die Zugabe von Actos zu Insulin beide HbA signifikant1c um 0,7% und 1,0% und FPG um 35 mg / dl und 49 mg / dl für die 15-mg- bzw. 30-mg-Dosis.
In der zweiten Studie erhielten 690 Patienten, die einen Median von 60,0 Einheiten pro Tag Insulin erhielten, 24 Wochen lang entweder 30 mg oder 45 mg Actos einmal täglich zusätzlich zu ihrem aktuellen Insulin-Regime. Die mittleren Verringerungen gegenüber dem Ausgangswert in Woche 24 in HbA1c waren 1,17% und 1,46% für die 30 mg bzw. 45 mg-Dosen. Die mittleren Verringerungen gegenüber dem Ausgangswert in FPG betrugen 31,9 mg / dl und 45,8 mg / dl. Eine verbesserte Blutzuckerkontrolle ging mit einer durchschnittlichen Abnahme des Insulindosisbedarfs von 6,0% bzw. 9,4% pro Tag für die 30-mg- bzw. 45-mg-Dosis gegenüber dem Ausgangswert einher.
Die therapeutische Wirkung von Actos in Kombination mit Insulin wurde bei Patienten beobachtet, unabhängig davon, ob die Patienten niedrigere oder höhere Insulindosen erhielten.
oben
Indikationen und Verwendung
Actos ist als Ergänzung zu Diät und Bewegung angezeigt, um die Blutzuckerkontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus zu verbessern.
oben
Kontraindikationen
Die Einleitung von Actos bei Patienten mit etablierter Herzinsuffizienz der Klasse III oder IV der New York Heart Association (NYHA) ist kontraindiziert (siehe Abschnitt 4.4) GEPACKTE WARNUNG).
Actos ist bei Patienten mit bekannter Überempfindlichkeit gegen dieses Produkt oder einen seiner Bestandteile kontraindiziert.
oben
Warnungen
Herzversagen und andere kardiale Effekte
Actos kann wie andere Thiazolidindione eine Flüssigkeitsretention verursachen, wenn es allein oder in Kombination mit anderen Antidiabetika, einschließlich Insulin, angewendet wird. Flüssigkeitsretention kann zu Herzinsuffizienz führen oder diese verschlimmern. Die Patienten sollten auf Anzeichen und Symptome einer Herzinsuffizienz hin beobachtet werden. Wenn sich diese Anzeichen und Symptome entwickeln, sollte die Herzinsuffizienz gemäß den aktuellen Behandlungsstandards behandelt werden. Darüber hinaus muss ein Absetzen oder eine Dosisreduktion von Actos in Betracht gezogen werden (siehe GEPACKTE WARNUNG). Patienten mit NYHA-Herzstatus der Klassen III und IV wurden während der klinischen Vorabgenehmigungsstudien nicht untersucht, und Actos wird bei diesen Patienten nicht empfohlen (siehe GEPACKTE WARNUNG und KONTRAINDIKATIONEN).
In einer 16-wöchigen doppelblinden, placebokontrollierten klinischen US-Studie mit 566 Patienten mit Typ 2 Diabetes, Actos in Dosen von 15 mg und 30 mg in Kombination mit Insulin wurde mit der Insulintherapie verglichen allein. Diese Studie umfasste Patienten mit langjährigem Diabetes und einer hohen Prävalenz vorbestehender Erkrankungen wie folgt: arterielle Hypertonie (57,2%), periphere Neuropathie (22,6%), koronare Herzkrankheit (19,6%), Retinopathie (13,1%), Myokard Infarkt (8,8%), Gefäßerkrankungen (6,4%), Angina pectoris (4,4%), Schlaganfall und / oder vorübergehende ischämische Attacke (4,1%) und kongestiv Herzinsuffizienz (2,3%).
In dieser Studie erhielten zwei der 191 Patienten 15 mg Actos plus Insulin (1,1%) und zwei der 188 Patienten 30 mg Actos plus Insulin (1,1%) entwickelte eine Herzinsuffizienz im Vergleich zu keinem der 187 Patienten unter Insulintherapie allein. Alle vier dieser Patienten hatten eine Vorgeschichte von Herz-Kreislauf-Erkrankungen, einschließlich einer Erkrankung der Herzkranzgefäße, früherer CABG-Eingriffe und eines Myokardinfarkts. In einer 24-wöchigen, dosisgesteuerten Studie, in der Actos zusammen mit Insulin verabreicht wurde, gaben 0,3% der Patienten (1/345) mit 30 mg und 0,9% (3/345) der Patienten mit 45 mg CHF als schwerwiegendes unerwünschtes Ereignis an .
Die Analyse der Daten aus diesen Studien ergab keine spezifischen Faktoren, die ein erhöhtes Risiko für Herzinsuffizienz bei Kombinationstherapie mit Insulin vorhersagen.
Bei Typ-2-Diabetes und Herzinsuffizienz (systolische Dysfunktion)
Eine 24-wöchige Sicherheitsstudie nach Markteinführung wurde durchgeführt, um Actos (n = 262) mit Glyburid (n = 256) bei unkontrollierten Diabetikern (mittlerer HbA) zu vergleichen1c 8,8% zu Studienbeginn) mit Herzinsuffizienz der NYHA-Klassen II und III und einer Auswurffraktion von weniger als 40% (mittlere EF 30% zu Studienbeginn). Im Verlauf der Studie wurde in 9,9% der Fälle über Nacht ein Krankenhausaufenthalt wegen Herzinsuffizienz gemeldet Patienten unter Actos verglichen mit 4,7% der Patienten unter Glyburide mit einem Behandlungsunterschied von 6 Wochen. Dieses mit Actos verbundene unerwünschte Ereignis war bei Patienten, die zu Studienbeginn Insulin verwendeten, und bei Patienten über 64 Jahren ausgeprägter. Es wurde kein Unterschied in der kardiovaskulären Mortalität zwischen den Behandlungsgruppen beobachtet.
Actos sollte mit der niedrigsten zugelassenen Dosis eingeleitet werden, wenn es für Patienten mit Typ-2-Diabetes und systolischer Herzinsuffizienz (NYHA-Klasse II) verschrieben wird. Wenn eine anschließende Dosiserhöhung erforderlich ist, sollte die Dosis erst nach mehreren Schritten erhöht werden monatelange Behandlung mit sorgfältiger Überwachung auf Gewichtszunahme, Ödeme oder Anzeichen und Symptome von CHF Exazerbation.
Prospektive klinische Pioglitazon-Studie bei makrovaskulären Ereignissen (PROactive)
In PROactive wurden 5238 Patienten mit Typ-2-Diabetes und makrovaskulären Erkrankungen in der Vorgeschichte mit Actos (n = 2605), bis zu 45 mg einmal täglich zwangstitriert oder mit Placebo (n = 2633) behandelt (siehe NEBENWIRKUNGEN). Der Prozentsatz der Patienten mit schwerer Herzinsuffizienz war bei mit Actos behandelten Patienten höher (5,7%, n = 149) als bei mit Placebo behandelten Patienten (4,1%, n = 108). Die Inzidenz des Todes nach Meldung einer schweren Herzinsuffizienz betrug 1,5% (n = 40) bei mit Actos behandelten Patienten und 1,4% (n = 37) bei mit Placebo behandelten Patienten. Bei Patienten, die zu Studienbeginn mit einer Insulin-haltigen Therapie behandelt wurden, betrug die Inzidenz schwerer Herzinsuffizienz unter Actos 6,3% (n = 54/864) und unter Placebo 5,2% (n = 47/896). Bei den Patienten, die zu Studienbeginn mit einem Sulfonylharnstoff-haltigen Schema behandelt wurden, betrug die Inzidenz schwerer Herzinsuffizienz unter Actos 5,8% (n = 94/1624) und unter Placebo 4,4% (n = 71/1626).
oben
Vorsichtsmaßnahmen
Allgemeines
Actos übt seine antihyperglykämische Wirkung nur in Gegenwart von Insulin aus. Daher sollte Actos nicht bei Patienten mit Typ-1-Diabetes oder zur Behandlung von diabetischer Ketoazidose angewendet werden.
Hypoglykämie: Bei Patienten, die Actos in Kombination mit Insulin oder oralen Hypoglykämika erhalten, besteht möglicherweise ein Risiko für eine Hypoglykämie, und eine Verringerung der Dosis des Begleitmedikaments kann erforderlich sein.
Kardiovaskulär: In placebokontrollierten klinischen Studien in den USA, in denen Patienten mit Herzstatus der Klassen III und IV der New York Heart Association (NYHA) ausgeschlossen wurden, wurde die Inzidenz von Bei Patienten, die mit Actos als Monotherapie oder in Kombination mit Sulfonylharnstoffen oder Metformin behandelt wurden, traten keine schwerwiegenden kardialen Nebenwirkungen im Zusammenhang mit der Volumenexpansion auf gegen Placebo-behandelte Patienten. In Insulin-Kombinationsstudien wurde eine kleine Anzahl von Patienten mit einer Vorgeschichte von zuvor existierenden Eine Herzerkrankung entwickelte eine kongestive Herzinsuffizienz, wenn sie mit Actos in Kombination mit Insulin behandelt wurde (sehen WARNUNGEN). Patienten mit NYHA-Herzstatus der Klassen III und IV wurden in diesen klinischen Actos-Studien nicht untersucht. Actos ist bei Patienten mit NYHA-Herzstatus der Klasse III oder IV nicht angezeigt.
Nach Markteinführung von Actos wurden Fälle von Herzinsuffizienz bei Patienten mit und ohne zuvor bekannte Herzerkrankung berichtet.
Ödeme: Actos sollte bei Patienten mit Ödemen mit Vorsicht angewendet werden. In allen klinischen Studien in den USA wurde bei mit Actos behandelten Patienten häufiger über Ödeme berichtet als bei mit Placebo behandelten Patienten NEBENWIRKUNGEN). Nach dem Inverkehrbringen sind Berichte über die Einleitung oder Verschlechterung von Ödemen eingegangen. Da Thiazolidindione, einschließlich Actos, eine Flüssigkeitsretention verursachen können, die die Herzinsuffizienz verschlimmern oder zu einer Herzinsuffizienz führen kann, sollte Actos bei Patienten mit einem Risiko für Herzinsuffizienz mit Vorsicht angewendet werden. Die Patienten sollten auf Anzeichen und Symptome einer Herzinsuffizienz überwacht werden (siehe GEPACKTE WARNUNG, WARNUNGEN, und VORSICHTSMASSNAHMEN).
Gewichtszunahme: Eine dosisabhängige Gewichtszunahme wurde mit Actos allein und in Kombination mit anderen hypoglykämischen Mitteln beobachtet (Tabelle 6). Der Mechanismus der Gewichtszunahme ist unklar, beinhaltet jedoch wahrscheinlich eine Kombination aus Flüssigkeitsretention und Fettansammlung.
Tabelle 6 Gewichtsveränderungen (kg) gegenüber dem Ausgangswert während doppelblinder klinischer Studien mit Actos
| Kontrollgruppe (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Median (25th/75th Perzentil) |
Median (25th/75th Perzentil) |
Median (25th/75th Perzentil) |
Median (25th/75th Perzentil) |
||
| Monotherapie | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinationstherapie | Sulfonylharnstoff | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformin | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insulin | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Hinweis: Probedauer von 16 bis 26 Wochen |
Eisprung: Wie andere Thiazolidindione kann auch die Therapie mit Actos bei einigen prämenopausalen anovulatorischen Frauen zum Eisprung führen. Infolgedessen besteht bei diesen Patienten möglicherweise ein erhöhtes Risiko für eine Schwangerschaft während der Einnahme von Actos. Daher sollte eine angemessene Empfängnisverhütung bei Frauen vor der Menopause empfohlen werden. Dieser mögliche Effekt wurde in klinischen Studien nicht untersucht, sodass die Häufigkeit dieses Auftretens nicht bekannt ist.
Hämatologisch: Actos kann eine Abnahme des Hämoglobins und des Hämatokrits verursachen. In allen klinischen Studien sanken die mittleren Hämoglobinwerte bei mit Actos behandelten Patienten um 2% bis 4%. Diese Veränderungen traten hauptsächlich innerhalb der ersten 4 bis 12 Wochen der Therapie auf und blieben danach relativ konstant. Diese Veränderungen können mit einem erhöhten Plasmavolumen zusammenhängen und waren selten mit signifikanten hämatologischen klinischen Effekten verbunden (siehe NEBENWIRKUNGEN, Laboranomalien).
Auswirkungen auf die Leber: In klinischen Studien vor der Zulassung wurden weltweit über 4500 Patienten mit Actos behandelt. In klinischen Studien in den USA erhielten über 4700 Patienten mit Typ-2-Diabetes Actos. In den klinischen Studien gab es keine Hinweise auf eine medikamenteninduzierte Hepatotoxizität oder eine Erhöhung der ALT-Spiegel.
Im Rahmen von placebokontrollierten klinischen Studien in den USA vor der Zulassung wurden insgesamt 4 von 1526 Patienten (0,26%) untersucht behandelt mit Actos und 2 von 793 (0,25%) mit Placebo behandelten Patienten hatten ALT-Werte - das Dreifache der Obergrenze von normal. Die ALT-Erhöhungen bei mit Actos behandelten Patienten waren reversibel und standen nicht eindeutig in Zusammenhang mit der Therapie mit Actos.
Nach Markteinführung von Actos wurden Berichte über Hepatitis und über Leberenzym-Erhöhungen bis zum 3-fachen oder mehr der oberen Normgrenze erhalten. Sehr selten betrafen diese Berichte ein Leberversagen mit und ohne tödlichen Ausgang, obwohl keine Kausalität nachgewiesen wurde.
Bis zur Verfügbarkeit der Ergebnisse weiterer großer, langfristig kontrollierter klinischer Studien und weiterer Nach der Markteinführung von Sicherheitsdaten wird empfohlen, dass Patienten, die mit Actos behandelt werden, einer regelmäßigen Leberüberwachung unterzogen werden Enzyme.
Serum-ALT-Spiegel (Alaninaminotransferase) sollten vor Beginn der Therapie mit untersucht werden Actos bei allen Patienten und danach periodisch nach klinischer Beurteilung des Gesundheitswesens Fachmann. Leberfunktionstests sollten auch für Patienten durchgeführt werden, wenn Symptome auftreten, die auf eine Leberfunktionsstörung hinweisen, z. B. Übelkeit, Erbrechen, Bauchschmerzen, Müdigkeit, Anorexie oder dunkler Urin. Die Entscheidung, ob der Patient mit Actos weiterbehandelt werden soll, sollte von der klinischen Beurteilung abhängig gemacht werden, bis Laboruntersuchungen vorliegen. Bei Auftreten eines Ikterus sollte die medikamentöse Therapie abgebrochen werden.
Die Therapie mit Actos sollte nicht begonnen werden, wenn der Patient klinische Anzeichen einer aktiven Lebererkrankung aufweist oder die ALT-Werte das 2,5-fache der Obergrenze des Normalwerts überschreiten. Patienten mit leicht erhöhten Leberenzymen (ALT-Spiegel beim 1- bis 2,5-fachen der Obergrenze des Normalwerts) bei Der Ausgangswert oder eine beliebige Zeit während der Behandlung mit Actos sollte ausgewertet werden, um die Ursache des Leberenzyms zu bestimmen Elevation. Beginn oder Fortsetzung der Therapie mit Actos bei Patienten mit leicht erhöhten Leberenzymen sollte fortgesetzt werden Vorsicht walten lassen und geeignete klinische Folgemaßnahmen einschließen, die häufigere Leberenzyme umfassen können Überwachung. Wenn die Serumtransaminasespiegel erhöht sind (ALT> 2,5-fache Obergrenze des Normalwerts), Leber Funktionstests sollten häufiger ausgewertet werden, bis die Werte wieder normal sind oder vorbehandelt wurden Werte. Wenn die ALT-Werte das Dreifache der Obergrenze des Normalwerts überschreiten, sollte der Test so bald wie möglich wiederholt werden. Wenn die ALT-Werte über dem 3-fachen des Normalwerts liegen oder wenn der Patient eine Gelbsucht hat, sollte die Actos-Therapie abgebrochen werden.
Makulaödem: Nach Markteinführung wurde bei Diabetikern, die Pioglitazon oder ein anderes Thiazolidindion einnahmen, über Makulaödeme berichtet. Einige Patienten wiesen Sehstörungen oder eine verminderte Sehschärfe auf, andere scheinen jedoch bei routinemäßigen augenärztlichen Untersuchungen diagnostiziert worden zu sein. Einige Patienten hatten zum Zeitpunkt der Diagnose eines Makulaödems ein peripheres Ödem. Einige Patienten hatten nach Absetzen ihres Thiazolidindions eine Besserung ihres Makulaödems. Es ist nicht bekannt, ob ein kausaler Zusammenhang zwischen Pioglitazon und Makulaödem besteht oder nicht. Patienten mit Diabetes sollten gemäß den Standards of Care der American Diabetes Association regelmäßige Augenuntersuchungen durch einen Augenarzt durchführen lassen. Darüber hinaus sollte jeder Diabetiker, der irgendein visuelles Symptom meldet, unverzüglich an einen Augenarzt überwiesen werden, unabhängig von den zugrunde liegenden Medikamenten oder anderen körperlichen Befunden des Patienten (siehe NEBENWIRKUNGEN).
Frakturen: In einer randomisierten Studie (PROactive) bei Patienten mit Typ 2 Diabetes (mittlere Dauer von Diabetes (9,5 Jahre) wurde bei weiblichen Patienten eine erhöhte Inzidenz von Knochenbrüchen festgestellt Pioglitazon. Während einer mittleren Nachbeobachtungszeit von 34,5 Monaten betrug die Inzidenz von Knochenbrüchen bei Frauen 5,1% (44/870) für Pioglitazon gegenüber 2,5% (23/905) für Placebo. Dieser Unterschied wurde nach dem ersten Behandlungsjahr festgestellt und blieb im Verlauf der Studie bestehen. Die Mehrzahl der bei weiblichen Patienten beobachteten Frakturen waren nicht-vertebrale Frakturen, einschließlich der unteren Extremität und der distalen oberen Extremität. Bei Männern, die mit Pioglitazon 1,7% (30/1735) gegenüber Placebo 2,1% (37/1728) behandelt wurden, wurde kein Anstieg der Frakturraten beobachtet. Das Risiko einer Fraktur sollte bei der Versorgung von Patienten, insbesondere von Patientinnen, die mit behandelt werden, berücksichtigt werden Pioglitazon und das Augenmerk sollten auf die Beurteilung und Aufrechterhaltung der Knochengesundheit gemäß den geltenden Standards gerichtet werden Pflege.
Makrovaskuläre Ergebnisse: Es liegen keine klinischen Studien vor, die einen schlüssigen Beweis für eine Reduzierung des makrovaskulären Risikos mit Actos oder einem anderen Antidiabetikum liefern.
Labortests
FPG und HbA1c Messungen sollten regelmäßig durchgeführt werden, um die Blutzuckerkontrolle und die therapeutische Reaktion auf Actos zu überwachen.
Die Überwachung der Leberenzyme wird vor Beginn der Actos - Therapie bei allen Patienten und danach in regelmäßigen Abständen nach klinischem Ermessen des medizinischen Fachpersonals empfohlen (siehe VORSICHTSMASSNAHMENAllgemeine hepatische Wirkungen und NEBENWIRKUNGENSerum-Transaminase-Spiegel).
Informationen für Patienten
Es ist wichtig, die Patienten anzuweisen, diätetische Anweisungen einzuhalten und den Blutzucker und das glykosylierte Hämoglobin regelmäßig testen zu lassen. In Stressphasen wie Fieber, Traumata, Infektionen oder Operationen können sich die Anforderungen an die Medikamente ändern, und die Patienten sollten daran erinnert werden, umgehend ärztlichen Rat einzuholen.
Patienten, bei denen eine ungewöhnlich schnelle Gewichtszunahme oder ein Ödem auftritt oder die Atemnot entwickeln oder andere Symptome einer Herzinsuffizienz, während Sie Actos einnehmen, sollten diese Symptome sofort ihrem Arzt melden Arzt.
Den Patienten ist mitzuteilen, dass vor Beginn der Therapie und danach in regelmäßigen Abständen nach klinischem Ermessen des medizinischen Fachpersonals Blutuntersuchungen auf Leberfunktion durchgeführt werden. Die Patienten sollten angewiesen werden, bei unerklärlicher Übelkeit, Erbrechen, Bauchschmerzen, Müdigkeit, Anorexie oder dunklem Urin sofort einen Arzt aufzusuchen.
Die Patienten sollten angewiesen werden, Actos einmal täglich einzunehmen. Actos kann mit oder ohne Mahlzeiten eingenommen werden. Wenn eine Dosis an einem Tag versäumt wird, sollte die Dosis am folgenden Tag nicht verdoppelt werden.
Bei Anwendung einer Kombinationstherapie mit Insulin oder oralen Hypoglykämika sind die Risiken einer Hypoglykämie, deren Symptome und Behandlung und Bedingungen, die für seine Entwicklung prädisponieren, sollten den Patienten und ihrer Familie erklärt werden Mitglieder.
Wie andere Thiazolidindione kann die Behandlung mit Actos bei einigen prämenopausalen anovulatorischen Frauen zum Eisprung führen. Infolgedessen besteht bei diesen Patienten möglicherweise ein erhöhtes Risiko für eine Schwangerschaft während der Einnahme von Actos. Daher sollte eine angemessene Empfängnisverhütung bei Frauen vor der Menopause empfohlen werden. Dieser mögliche Effekt wurde in klinischen Studien nicht untersucht, sodass die Häufigkeit dieses Auftretens nicht bekannt ist.
Wechselwirkungen mit anderen Medikamenten
In-vivo-Wechselwirkungsstudien mit Arzneimitteln haben gezeigt, dass Pioglitazon ein schwacher Induktor des isoformen 3A4-Substrats von CYP 450 ist (siehe KLINISCHE PHARMAKOLOGIE, Stoffwechsel und Arzneimittel-Wechselwirkungen).
Ein Enzymhemmer von CYP2C8 (wie Gemfibrozil) kann die AUC von signifikant erhöhen Pioglitazon und ein Enzym-Induktor von CYP2C8 (wie Rifampin) können die AUC von signifikant senken Pioglitazon. Wenn daher ein Inhibitor oder Induktor von CYP2C8 während der Behandlung mit Pioglitazon gestartet oder gestoppt wird, kann eine Änderung der Diabetesbehandlung aufgrund des klinischen Ansprechens erforderlich sein (siehe KLINISCHE PHARMAKOLOGIE, Arzneimittel-Wechselwirkungen).
Karzinogenese, Mutagenese, Fruchtbarkeitsstörung
Eine zweijährige Kanzerogenitätsstudie wurde an männlichen und weiblichen Ratten in oralen Dosen von bis zu 63 mg / kg durchgeführt (ungefähr das 14-fache der empfohlenen oralen Höchstdosis beim Menschen von 45 mg, bezogen auf mg / m²). Arzneimittelinduzierte Tumoren wurden in keinem Organ außer in der Harnblase beobachtet. Bei männlichen Ratten wurden benigne und / oder maligne Übergangszell-Neoplasien ab 4 mg / kg / Tag beobachtet (ungefähr gleich der empfohlenen maximalen oralen Dosis beim Menschen, bezogen auf mg / m²). Eine zweijährige Kanzerogenitätsstudie wurde an männlichen und weiblichen Mäusen in oralen Dosen von bis zu 100 mg / kg / Tag durchgeführt (ungefähr das 11-fache der empfohlenen oralen Höchstdosis beim Menschen, bezogen auf mg / m²). In keinem Organ wurden arzneimittelinduzierte Tumoren beobachtet.
Bei der prospektiven Bewertung der Harnzytologie mit mehr als 1800 Patienten, die Actos in klinischen Studien mit einer Dauer von bis zu einem Jahr erhielten, wurden keine neuen Fälle von Blasentumoren festgestellt. In zwei 3-Jahres-Studien, in denen Pioglitazon mit Placebo oder Glyburid verglichen wurde, wurden 16/3656 (0,44%) Berichte über Blasenkrebs bei Patienten unter Pioglitazon im Vergleich zu 5/3679 (0,14%) bei Patienten ohne Pioglitazon Pioglitazon. Nach dem Ausschluss von Patienten, bei denen die Exposition gegenüber dem Studienmedikament zum Zeitpunkt der Diagnose von Blasenkrebs weniger als ein Jahr betrug, gab es unter Pioglitazon sechs (0,16%) und unter Placebo zwei (0,05%) Fälle.
Pioglitazon HCl war in einer Reihe genetischer Toxikologiestudien, einschließlich des Ames-Bakterientests, einem Vorwärtsgen für Säugerzellen, nicht mutagen Mutationstest (CHO / HPRT und AS52 / XPRT), ein In-vitro-Zytogenetiktest unter Verwendung von CHL-Zellen, ein außerplanmäßiger DNA-Synthesetest und ein In-vivo-Mikronukleus Assay.
Bei männlichen und weiblichen Ratten wurden bei oralen Dosen von bis zu 40 mg / kg Pioglitazon-HCl täglich keine nachteiligen Auswirkungen auf die Fertilität beobachtet vor und während der Paarung und der Trächtigkeit (ungefähr das Neunfache der empfohlenen oralen Höchstdosis beim Menschen, bezogen auf mg / m2).
Animal Toxicology
Eine Herzvergrößerung wurde bei Mäusen (100 mg / kg), Ratten (4 mg / kg und mehr) und Hunden (3 mg / kg) beobachtet, die oral mit behandelt wurden Pioglitazon-HCl (ungefähr das 11-, 1- und 2-fache der empfohlenen oralen Höchstdosis beim Menschen für Mäuse, Ratten und Hunde), bezogen auf mg / m2). In einer einjährigen Rattenstudie kam es zu einem drogenbedingten frühen Tod aufgrund einer offensichtlichen Herzfunktionsstörung bei einer orale Dosis von 160 mg / kg / Tag (ungefähr das 35fache der empfohlenen menschlichen oralen Höchstdosis auf der Grundlage von mg / m2). Eine Herzvergrößerung wurde in einer 13-wöchigen Studie an Affen bei oralen Dosen von 8,9 mg / kg und darüber beobachtet (ungefähr das Vierfache der empfohlenen oralen Höchstdosis beim Menschen, bezogen auf mg / m)2), jedoch nicht in einer 52-wöchigen Studie mit oralen Dosen von bis zu 32 mg / kg (ungefähr das 13-fache der empfohlenen oralen Höchstdosis beim Menschen, bezogen auf mg / m2).
Schwangerschaft
Schwangerschaftskategorie C. Pioglitazon war bei Ratten in oralen Dosen bis zu 80 mg / kg oder bei Kaninchen bis zu 160 mg / kg nicht teratogen mg / kg während der Organogenese (ungefähr das 17 - und 40 - fache der empfohlenen oralen Höchstdosis beim Menschen auf der Grundlage von auf mg / m2, beziehungsweise). Verzögerte Entbindung und Embryotoxizität (wie durch erhöhte Postimplantationsverluste, verzögerte Entwicklung und verringerte fetale Gewichte belegt) wurden bei Ratten bei oralen Dosen von 40 mg / kg / Tag und darüber beobachtet (ungefähr das Zehnfache der empfohlenen maximalen oralen Dosis beim Menschen, basierend auf mg / m2). Bei Nachkommen von Ratten wurde keine funktionelle oder Verhaltenstoxizität beobachtet. Bei Kaninchen wurde eine Embryotoxizität bei einer oralen Dosis von 160 mg / kg beobachtet (ungefähr das 40fache der empfohlenen menschlichen oralen Höchstdosis, bezogen auf mg / m 2)2). Eine verzögerte postnatale Entwicklung, die auf ein verringertes Körpergewicht zurückzuführen ist, wurde bei Nachkommen von Ratten bei oralen Dosen von 10 mg / kg beobachtet und darüber während der späten Schwangerschaft und Stillzeit (ungefähr das Zweifache der empfohlenen maximalen oralen Dosis beim Menschen auf der Grundlage von mg / m2).
Es gibt keine ausreichenden und gut kontrollierten Studien bei schwangeren Frauen. Actos sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Da die aktuellen Informationen stark darauf hindeuten, dass abnormale Blutzuckerspiegel während der Schwangerschaft auch mit einer höheren Inzidenz von angeborenen Anomalien verbunden sind Aufgrund der erhöhten Morbidität und Mortalität von Neugeborenen empfehlen die meisten Experten, während der Schwangerschaft Insulin zu verwenden, um den Blutzuckerspiegel so nahe wie möglich an der Norm zu halten möglich.
Stillende Mutter
Pioglitazon wird in die Milch laktierender Ratten abgegeben. Es ist nicht bekannt, ob Actos in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch übergehen, darf Actos nicht an stillende Frauen verabreicht werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von Actos bei pädiatrischen Patienten wurden nicht untersucht.
Gebrauch durch ältere Menschen
Ungefähr 500 Patienten in placebokontrollierten klinischen Studien mit Actos waren 65 Jahre und älter. Es wurden keine signifikanten Unterschiede in Bezug auf Wirksamkeit und Sicherheit zwischen diesen Patienten und jüngeren Patienten beobachtet.
oben
Nebenwirkungen
Über 8500 Patienten mit Typ-2-Diabetes wurden in randomisierten, doppelblinden, kontrollierten klinischen Studien mit Actos behandelt. Dies umfasst 2605 Hochrisikopatienten mit Typ-2-Diabetes, die mit Actos aus der klinischen Studie PROactive behandelt wurden. Über 6000 Patienten wurden 6 Monate oder länger und über 4500 Patienten ein Jahr oder länger behandelt. Über 3000 Patienten haben Actos seit mindestens 2 Jahren erhalten.
Die Gesamtinzidenz und die Arten unerwünschter Ereignisse, die in placebokontrollierten klinischen Studien mit Actos-Monotherapie in Dosen von 7,5 mg, 15 mg, 30 mg oder 45 mg einmal täglich berichtet wurden, sind in Tabelle 7 aufgeführt.
Tabelle 7 Placebo-kontrollierte klinische Studien zur Actos-Monotherapie: Nebenwirkungen, die mit einer Häufigkeit von 5% der mit Actos behandelten Patienten berichtet wurden
| (% der Patienten) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Infektionen der oberen Atemwege | 8.5 | 13.2 |
| Kopfschmerzen | 6.9 | 9.1 |
| Sinusitis | 4.6 | 6.3 |
| Myalgie | 2.7 | 5.4 |
| Zahnstörung | 2.3 | 5.3 |
| Diabetes mellitus verschlimmert | 8.1 | 5.1 |
| Pharyngitis | 0.8 | 5.1 |
Bei den meisten klinischen Nebenwirkungen war die Inzidenz bei Gruppen, die mit Actos-Monotherapie und in Kombination mit Sulfonylharnstoffen, Metformin und Insulin behandelt wurden, ähnlich. Das Auftreten von Ödemen war bei den mit Actos und Insulin behandelten Patienten im Vergleich zu Insulin allein erhöht.
In einer 16-wöchigen placebokontrollierten Actos plus-Insulinstudie (n = 379) wurden 10 Patienten mit Actos plus behandelt Insulin entwickelte Dyspnoe und irgendwann während der Therapie eine Gewichtsveränderung oder Ödem. Sieben dieser 10 Patienten erhielten Diuretika, um diese Symptome zu behandeln. Dies wurde in der Insulin-plus-Placebo-Gruppe nicht berichtet.
Die Häufigkeit von Entlassungen aus placebokontrollierten klinischen Studien aufgrund eines anderen unerwünschten Ereignisses als Hyperglykämie war bei Patienten, die mit Placebo (2,8%) oder Actos (3,3%) behandelt wurden, ähnlich.
In Studien mit kontrollierter Kombinationstherapie mit Sulfonylharnstoff oder Insulin wurde über eine leichte bis mittelschwere Hypoglykämie berichtet, die dosisabhängig zu sein scheint (vgl VORSICHTSMASSNAHMENAllgemein, Hypoglykämie und Dosierung und Anwendung, Kombinationstherapie).
In Doppelblindstudien in den USA wurde bei 2% der mit Actos plus Sulfonylharnstoff, Metformin oder Insulin behandelten Patienten eine Anämie berichtet (vgl VORSICHTSMASSNAHMENAllgemein, hämatologisch).
In Monotherapie-Studien wurde für 4,8% (mit Dosen von 7,5 mg bis 45 mg) der mit Actos behandelten Patienten ein Ödem berichtet, gegenüber 1,2% der mit Placebo behandelten Patienten. In kombinierten Therapiestudien wurde bei 7,2% der mit Actos und Sulfonylharnstoffen behandelten Patienten ein Ödem berichtet, verglichen mit 2,1% der Patienten, die nur Sulfonylharnstoffe erhielten. In Kombinationstherapiestudien mit Metformin wurde bei 6,0% der Patienten unter Kombinationstherapie ein Ödem berichtet, verglichen mit 2,5% der Patienten unter Metformin allein. In Kombinationstherapiestudien mit Insulin wurde bei 15,3% der Patienten unter Kombinationstherapie ein Ödem berichtet, verglichen mit 7,0% der Patienten unter Insulin allein. Die meisten dieser Ereignisse wurden als mild oder mittelschwer eingestuft (vgl VORSICHTSMASSNAHMENAllgemein, Ödem).
In einer 16-wöchigen klinischen Studie mit Insulin plus Actos-Kombinationstherapie entwickelten mehr Patienten unter Kombinationstherapie eine kongestive Herzinsuffizienz (1,1%) als unter Insulin allein (siehe WARNUNGEN, Herzinsuffizienz und andere Herzeffekte).
Prospektive klinische Pioglitazon-Studie bei makrovaskulären Ereignissen (PROactive)
In PROactive waren 5238 Patienten mit Typ-2-Diabetes und einer Vorgeschichte von makrovaskulären Erkrankungen mit Actos (n = 2605) behandelt, zusätzlich zu Standard bis zu 45 mg täglich oder Placebo (n = 2633) zwangstitriert Pflege. Fast alle Probanden (95%) erhielten kardiovaskuläre Medikamente (Betablocker, ACE-Hemmer, ARBs, Kalziumkanalblocker, Nitrate, Diuretika, Aspirin, Statine, Fibrate). Die Patienten hatten ein Durchschnittsalter von 61,8 Jahren, eine durchschnittliche Diabetesdauer von 9,5 Jahren und einen durchschnittlichen HbA1c-Wert von 8,1%. Die durchschnittliche Follow-up-Dauer betrug 34,5 Monate. Das Hauptziel dieser Studie war die Untersuchung der Auswirkungen von Actos auf die Mortalität und makrovaskuläre Morbidität bei Patienten mit Typ - 2 - Diabetes mellitus, bei denen ein hohes Risiko für eine Erkrankung bestand makrovaskuläre Ereignisse. Die primäre Wirksamkeitsvariable war der Zeitpunkt bis zum ersten Auftreten eines Ereignisses im kardiovaskulären zusammengesetzten Endpunkt (siehe Tabelle 8 unten). Obwohl es keinen statistisch signifikanten Unterschied zwischen Actos und Placebo für die 3-Jahres-Inzidenz von gab Ein erstes Ereignis innerhalb dieses Komposits, bei dem es keine Zunahme der Mortalität oder der makrovaskulären Ereignisse gab Actos.
Tabelle 8 Anzahl der ersten und Gesamtereignisse für jede Komponente innerhalb des kardiovaskulären zusammengesetzten Endpunkts
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Herz-Kreislauf-Ereignisse | Erste Ereignisse (N) |
Ereignisse insgesamt (N) |
Erste Ereignisse (N) |
Ereignisse insgesamt (N) |
| Jedes Ereignis | 572 | 900 | 514 | 803 |
| Gesamtmortalität | 122 | 186 | 110 | 177 |
| Nicht tödlicher MI | 118 | 157 | 105 | 131 |
| Schlaganfall | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Herzintervention | 101 | 240 | 101 | 195 |
| Große Beinamputation | 15 | 28 | 9 | 28 |
| Beinrevaskularisation | 57 | 92 | 71 | 115 |
Postmarketing - Berichte über neu auftretende oder sich verschlimmernde diabetische Makulaödeme mit verminderter Sehschärfe liegen ebenfalls vor (vgl VORSICHTSMASSNAHMEN, Allgemeines, Makulaödem).
Laboranomalien
Hämatologisch: Actos kann eine Abnahme des Hämoglobins und des Hämatokrits verursachen. Der Abfall von Hämoglobin und Hämatokrit bei Actos scheint dosisabhängig zu sein. In allen klinischen Studien sanken die mittleren Hämoglobinwerte bei mit Actos behandelten Patienten um 2% bis 4%. Diese Veränderungen traten im Allgemeinen innerhalb der ersten 4 bis 12 Wochen der Therapie auf und blieben danach relativ stabil. Diese Veränderungen können mit einem erhöhten Plasmavolumen in Verbindung mit der Actos-Therapie zusammenhängen und waren selten mit signifikanten hämatologischen klinischen Effekten verbunden.
Serumtransaminasespiegel: Während aller klinischen Studien in den USA hatten 14 von 4780 (0,30%) mit Actos behandelten Patienten ALT-Werte - das Dreifache der Obergrenze des Normalwerts während der Behandlung. Alle Patienten mit Follow-up-Werten hatten reversible Erhöhungen der ALT. In der Population der mit Actos behandelten Patienten waren die Mittelwerte für Bilirubin, AST, ALT, alkalische Phosphatase und GGT beim letzten Besuch im Vergleich zum Ausgangswert gesunken. In den USA wurden weniger als 0,9% der mit Actos behandelten Patienten aufgrund abnormaler Leberfunktionstests aus klinischen Studien zurückgezogen.
In klinischen Studien vor der Zulassung gab es keine Fälle von eigenwilligen Arzneimittelreaktionen, die zu Leberversagen führten (vgl VORSICHTSMASSNAHMENAllgemeine hepatische Wirkungen).
CPK-Spiegel: Während erforderlicher Labortests in klinischen Studien wurden sporadische, vorübergehende Erhöhungen der Kreatinphosphokinasespiegel (CPK) beobachtet. Bei 9 Patienten (Werte von 2150 bis 11400 IE / l) wurde eine isolierte Erhöhung auf mehr als das Zehnfache der Normalobergrenze festgestellt. Sechs dieser Patienten erhielten weiterhin Actos, zwei Patienten hatten die Studie abgeschlossen Medikation zum Zeitpunkt des erhöhten Wertes und ein Patient brach die Studienmedikation aufgrund der Elevation. Diese Erhöhungen lösten sich ohne erkennbare klinische Folgen auf. Die Beziehung dieser Ereignisse zur Actos-Therapie ist unbekannt.
oben
Überdosis
In kontrollierten klinischen Studien wurde ein Fall einer Überdosierung mit Actos berichtet. Ein männlicher Patient nahm vier Tage lang 120 mg pro Tag und dann sieben Tage lang 180 mg pro Tag ein. Der Patient bestritt während dieser Zeit keine klinischen Symptome.
Im Falle einer Überdosierung sollte eine geeignete unterstützende Behandlung gemäß den klinischen Anzeichen und Symptomen des Patienten eingeleitet werden.
oben
Dosierung und Anwendung
Actos sollte einmal täglich unabhängig von den Mahlzeiten eingenommen werden.
Das Management der Antidiabetika-Therapie sollte individualisiert werden. Idealerweise sollte das Ansprechen auf die Therapie mit HbA bewertet werden1c Dies ist ein besserer Indikator für die langfristige Blutzuckerkontrolle als FPG allein. HbA1c spiegelt die Glykämie der letzten zwei bis drei Monate wider. Bei der klinischen Anwendung wird empfohlen, dass Patienten über einen Zeitraum mit Actos behandelt werden, der ausreicht, um die Veränderung des HbA zu bewerten1c (drei Monate), sofern sich die Blutzuckerkontrolle nicht verschlechtert. Nach der Einleitung von Actos oder mit einer Dosiserhöhung sollten die Patienten sorgfältig auf unerwünschte Ereignisse im Zusammenhang mit der Flüssigkeitsretention überwacht werden (siehe Abschnitt 4.4) GEPACKTE WARNUNG und WARNUNGEN).
Monotherapie
Die Actos-Monotherapie bei Patienten, die mit Diät und Bewegung nicht ausreichend kontrolliert werden, kann einmal täglich mit 15 mg oder 30 mg begonnen werden. Bei Patienten, die nicht ausreichend auf die Anfangsdosis von Actos ansprechen, kann die Dosis in Schritten von bis zu 45 mg einmal täglich erhöht werden. Bei Patienten, die nicht ausreichend auf eine Monotherapie ansprechen, sollte eine Kombinationstherapie in Betracht gezogen werden.
Kombinationstherapie
Sulfonylharnstoffe: Actos in Kombination mit einem Sulfonylharnstoff kann einmal täglich mit 15 mg oder 30 mg eingeleitet werden. Die derzeitige Sulfonylharnstoffdosis kann zu Beginn der Actos-Therapie fortgesetzt werden. Wenn Patienten von einer Hypoglykämie berichten, sollte die Dosis des Sulfonylharnstoffs verringert werden.
Metformin: Actos in Kombination mit Metformin kann einmal täglich mit 15 mg oder 30 mg eingeleitet werden. Die derzeitige Metformin-Dosis kann zu Beginn der Actos-Therapie fortgesetzt werden. Es ist unwahrscheinlich, dass die Dosis von Metformin aufgrund einer Hypoglykämie während der Kombinationstherapie mit Actos angepasst werden muss.
Insulin: Actos in Kombination mit Insulin kann einmal täglich mit 15 mg oder 30 mg eingeleitet werden. Die aktuelle Insulindosis kann zu Beginn der Actos-Therapie fortgesetzt werden. Bei Patienten, die Actos und Insulin erhalten, kann die Insulindosis um 10% bis 25% verringert werden, wenn der Patient eine Hypoglykämie meldet oder wenn die Plasmaglucosekonzentration auf weniger als 100 mg / dl abfällt. Weitere Anpassungen sollten basierend auf der Reaktion zur Senkung der Glukose individualisiert werden.
Empfohlene Höchstdosis
Die Actos-Dosis sollte 45 mg einmal täglich in Monotherapie oder in Kombination mit Sulfonylharnstoff, Metformin oder Insulin nicht überschreiten.
Eine Dosisanpassung bei Patienten mit Niereninsuffizienz wird nicht empfohlen (siehe KLINISCHE PHARMAKOLOGIEPharmakokinetik und Arzneimittelstoffwechsel).
Eine Therapie mit Actos sollte nicht eingeleitet werden, wenn der Patient klinische Anzeichen einer aktiven Lebererkrankung aufweist oder Erhöhte Serumtransaminasespiegel (ALT größer als das 2,5-fache der Obergrenze des Normalwerts) zu Beginn der Therapie (sehen VORSICHTSMASSNAHMENAllgemeine hepatische Wirkungen und KLINISCHE PHARMAKOLOGIE, Spezielle Populationen, Leberinsuffizienz). Eine Überwachung der Leberenzyme wird bei allen Patienten vor Beginn der Therapie mit Actos und in regelmäßigen Abständen danach empfohlen (siehe Abschnitt 4.4) VORSICHTSMASSNAHMENAllgemeine hepatische Wirkungen).
Es liegen keine Daten zur Anwendung von Actos bei Patienten unter 18 Jahren vor. Daher wird die Anwendung von Actos bei pädiatrischen Patienten nicht empfohlen.
Es liegen keine Daten zur Anwendung von Actos in Kombination mit einem anderen Thiazolidindion vor.
oben
Wie geliefert
Actos ist in folgenden Tabletten zu 15 mg, 30 mg und 45 mg erhältlich:
15 mg Tablette: Weiße bis cremefarbene, runde, konvexe Tablette ohne Kerben mit "Actos" auf der einen und "15" auf der anderen Seite. Erhältlich in:
NDC 64764-151-04 Flaschen mit 30 Stück
NDC 64764-151-05 Flaschen mit 90 Stück
NDC 64764-151-06 Flaschen mit 500 Stück
30 mg Tablette: Weiße bis cremefarbene, runde, flache Tablette ohne Kerben mit "Actos" auf der einen und "30" auf der anderen Seite. Erhältlich in:
NDC 64764-301-14 Flaschen mit 30 Stück
NDC 64764-301-15 Flaschen mit 90 Stück
NDC 64764-301-16 Flaschen mit 500 Stück
45 mg Tablette: weiße bis cremefarbene, runde, flache Tablette ohne Kerben mit "Actos" auf der einen Seite und "45" auf der anderen Seite. Erhältlich in:
NDC 64764-451-24 Flaschen à 30 Stück
NDC 64764-451-25 Flaschen mit 90 Stück
NDC 64764-451-26 Flaschen à 500 Stück
LAGER
Bei 25 ° C lagern. zulässige Exkursionen bis 15-30 ° C (59-86 ° F) [siehe USP Controlled Room Temperature]. Behälter dicht geschlossen halten und vor Nässe und Feuchtigkeit schützen.
oben
Verweise
- Deng, LJ et al. Einfluss von Gemfibrozil auf die Pharmakokinetik von Pioglitazon. Eur J Clin Pharmacol 2005; 61: 831 & ndash; 836, Tabelle 1.
2. Jaakkola, T et al. Wirkung von Rifampicin auf die Pharmakokinetik von Pioglitazon. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Nur Empfang
Hergestellt von:
Takeda Pharmaceutical Company Limited
Osaka, Japan
Vermarktet von:
Takeda Pharmaceuticals America, Inc.
Ein Takeda Parkway
Deerfield, IL 60015
Actos® ist eine eingetragene Marke von Takeda Pharmaceutical Company Limited und wird unter Lizenz von Takeda Pharmaceuticals America, Inc. verwendet.
Alle anderen Markennamen sind Eigentum ihrer jeweiligen Inhaber.
Letzte Aktualisierung: 08/09
Actos, Pioglitazon hcl, Patienteninformation (in reinem Englisch)
Detaillierte Informationen zu Anzeichen, Symptomen, Ursachen und Behandlungen von Diabetes
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen benötigen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
zurück zu: Durchsuchen Sie alle Medikamente für Diabetes



