Iloperidone (fanapt) Vollständige Verschreibungsinformationen
Markenname: Fanapt
Gattungsname: Iloperidone
Verschreibungshandbuch für Fanapt (Iloperidone) (PDF)
Inhalt:
Boxed Warnung
Indikationen und Verwendung
Dosierung und Anwendung
Kontraindikationen
Warnungen und Vorsichtsmaßnahmen
Nebenwirkungen
Wechselwirkungen mit anderen Medikamenten
Verwendung in bestimmten Populationen
Drogenmissbrauch und Abhängigkeit
Überdosis
Beschreibung
Klinische Pharmakologie
Nichtklinische Toxikologie
Klinische Studien
Wie geliefert
Brintellix Medikationshandbuch
WARNUNG: ERHÖHTE MORTALITÄT BEI ÄLTEREN PATIENTEN MIT DEMENZBEZOGENER PSYCHOSE
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Todesrisiko. FANAPT ist nicht zur Behandlung von Patienten mit demenzbedingter Psychose zugelassen.
Indikationen und Verwendung
FANAPT® ist zur Behandlung von Schizophrenie bei Erwachsenen indiziert.
Bei der Entscheidung über die für diese Erkrankung verfügbaren alternativen Behandlungen sollte der verschreibende Arzt die Feststellung berücksichtigen, dass FANAPT mit einer Verlängerung des QTc-Intervalls verbunden ist. Eine Verlängerung des QTc-Intervalls ist bei einigen anderen Arzneimitteln mit der Fähigkeit verbunden, Torsade-De zu verursachen Pointes-Arrhythmie, eine möglicherweise tödliche polymorphe ventrikuläre Tachykardie, die zu plötzlichen Ereignissen führen kann Tod. In vielen Fällen würde dies zu der Schlussfolgerung führen, dass zuerst andere Medikamente ausprobiert werden sollten. Ob FANAPT Torsade de Pointes hervorruft oder die Rate plötzlicher Todesfälle erhöht, ist noch nicht bekannt.
Die Patienten müssen auf eine wirksame FANAPT-Dosis eingestellt werden. Daher kann die Kontrolle der Symptome während der ersten 1 bis 2 Wochen der Behandlung im Vergleich zu einigen anderen Antipsychotika, die keine ähnliche Titration erfordern, verzögert sein. Die Verschreiber sollten diese Verzögerung berücksichtigen, wenn sie ein Antipsychotikum zur Behandlung von Schizophrenie auswählen.
Fortsetzung der Geschichte unten
Dosierung und Anwendung
Übliche Dosis
FANAPT muss ab einer niedrigen Anfangsdosis langsam titriert werden, um eine orthostatische Hypotonie aufgrund seiner alpha-adrenergen Blockierungseigenschaften zu vermeiden. Die empfohlene Anfangsdosis für FANAPT-Tabletten beträgt 1 mg oral zweimal täglich. Dosiserhöhungen, um den Zielbereich von 6 bis 12 mg zweimal täglich (12 bis 24 mg / Tag) zu erreichen, können mit täglichen Dosisanpassungen vorgenommen werden, die 2 mg zweimal täglich (4 mg / Tag) nicht überschreiten. Die empfohlene Höchstdosis beträgt 12 mg zweimal täglich (24 mg / Tag). FANAPT-Dosen über 24 mg / Tag wurden in den klinischen Studien nicht systematisch bewertet. Die Wirksamkeit wurde mit FANAPT in einem Dosisbereich von 6 bis 12 mg zweimal täglich nachgewiesen. Verschreiber sollten sich der Tatsache bewusst sein, dass Patienten auf eine wirksame FANAPT-Dosis eingestellt werden müssen. Daher kann die Kontrolle der Symptome während der ersten 1 bis 2 Wochen der Behandlung im Vergleich zu einigen anderen Antipsychotika, die keine ähnliche Titration erfordern, verzögert sein. Verschreiber sollten sich auch darüber im Klaren sein, dass einige mit der Anwendung von FANAPT verbundene Nebenwirkungen dosisabhängig sind. FANAPT kann unabhängig von den Mahlzeiten angewendet werden.
Dosierung in speziellen Populationen
Dosisanpassung bei Patienten, die FANAPT gleichzeitig mit potenziellen CYP2D6-Hemmern einnehmen: Die FANAPT-Dosis sollte betragen Reduziert um die Hälfte bei gleichzeitiger Gabe von starken CYP2D6-Hemmern wie Fluoxetin oder Paroxetin. Wenn der CYP2D6-Hemmer aus der Kombinationstherapie genommen wird, sollte die FANAPT-Dosis auf die vorherige Dosis erhöht werden.
Dosisanpassung bei Patienten, die FANAPT gleichzeitig mit potenziellen CYP3A4-Hemmern einnehmen: Die FANAPT-Dosis sollte betragen reduziert um die Hälfte bei gleichzeitiger Gabe von starken CYP3A4-Inhibitoren wie Ketoconazol oder Clarithromycin. Wenn der CYP3A4-Hemmer aus der Kombinationstherapie genommen wird, sollte die FANAPT-Dosis auf die vorherige Dosis erhöht werden.
Dosisanpassung bei Patienten, die FANAPT einnehmen und CYP2D6 schlecht metabolisieren: Die FANAPT-Dosis sollte bei Patienten mit CYP2D6 schlecht metabolisieren um die Hälfte reduziert werden.
Leberfunktionsstörung: Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung an FANAPT erforderlich. Bei Patienten mit mittelschwerer Leberfunktionsstörung kann eine Dosisreduktion erforderlich sein, wenn dies klinisch angezeigt ist. Bei Patienten mit schwerer Leberfunktionsstörung wird FANAPT nicht empfohlen.
Erhaltungstherapie
In einer Langzeitstudie verzögerte FANAPT die Zeit bis zum Rückfall bei Patienten mit Schizophrenie, die auf FANAPT bis zu 24 mg / Tag stabilisiert waren. Die Patienten sollten regelmäßig überprüft werden, um festzustellen, ob eine Erhaltungstherapie erforderlich ist.
Wiederaufnahme der Behandlung bei Patienten, die zuvor abgesetzt wurden Obwohl es keine Daten gibt, die speziell auf die Wiederaufnahme der Behandlung von Patienten eingehen Es wird empfohlen, den Zeitplan für die Einleitung der Titration einzuhalten, wenn die Patienten ein Intervall von mehr als FANAPT hatten als 3 tage.
oben
Darreichungsformen und Stärken
FANAPT-Tabletten sind in folgenden Stärken erhältlich: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg und 12 mg. Die Tabletten sind weiß, rund, flach, mit abgeschrägten Kanten versehen und mit einem einseitig geprägten Logo und der Tablettenstärke „1“, „2“, „4“, „6“, „8“, „10“ gekennzeichnet. oder "12" auf der anderen Seite geprägt.
oben
Kontraindikationen
FANAPT ist bei Personen mit bekannter Überempfindlichkeitsreaktion gegen das Produkt kontraindiziert. Über Anaphylaxie, Angioödem und andere Überempfindlichkeitsreaktionen wurde berichtet.
oben
WARNUNGEN UND VORSICHTSMASSNAHMEN
Erhöhte Mortalität bei älteren Patienten mit demenzbedingter Psychose
Antipsychotika erhöhen das allgemeine Todesrisiko bei älteren Patienten mit demenzbedingter Psychose. Analysen von 17 plazebokontrollierten Studien zur demenzbedingten Psychose (Modaldauer 10 Wochen und überwiegend bei atypisch behandelten Patienten) Antipsychotika) zeigten bei den mit Medikamenten behandelten Patienten ein 1,6- bis 1,7-fach höheres Sterberisiko als bei den mit Placebo behandelten Patienten. Im Verlauf einer typischen 10-wöchigen kontrollierten Studie lag die Sterblichkeitsrate bei mit Medikamenten behandelten Patienten bei etwa 4,5%, verglichen mit einer Rate von etwa 2,6% bei mit Placebo behandelten Patienten.
Obwohl die Todesursachen unterschiedlich waren, schienen die meisten Todesfälle entweder kardiovaskulärer Natur (z. B. Herzinsuffizienz, plötzlicher Tod) oder infektiöser Natur (z. B. Lungenentzündung) zu sein. FANAPT ist nicht zur Behandlung von Patienten mit demenzbedingter Psychose zugelassen.
Zerebrovaskuläre Nebenwirkungen, einschließlich Schlaganfall, bei älteren Patienten mit demenzbedingter Psychose
In placebokontrollierten Studien mit älteren Patienten mit Demenz wurden Patienten, die nach dem Zufallsprinzip Risperidon erhielten, Aripiprazol und Olanzapin hatten eine höhere Inzidenz von Schlaganfällen und vorübergehenden ischämischen Attacken, einschließlich tödlicher Schlaganfall. FANAPT ist nicht zur Behandlung von Patienten mit demenzbedingter Psychose zugelassen.
QT-Verlängerung
In einer offenen QTc-Studie bei Patienten mit Schizophrenie oder schizoaffektiver Störung (n = 160) war FANAPT mit einer QTc-Verlängerung von 9 ms bei einer Iloperidon-Dosis von 12 mg zweimal täglich assoziiert. Die Wirkung von FANAPT auf das QT-Intervall wurde durch das Vorhandensein einer metabolischen Hemmung von CYP450 2D6 oder 3A4 (Paroxetin 20 mg einmal täglich bzw. Ketoconazol 200 mg zweimal täglich) verstärkt. Unter metabolischen Hemmungsbedingungen für 2D6 und 3A4 war FANAPT 12 mg zweimal täglich mit einem mittleren QTcF-Anstieg von etwa 19 ms gegenüber dem Ausgangswert verbunden.
Während des klinischen Programms vor der Markteinführung wurden keine Fälle von Torsade de Pointes oder anderen schweren Herzrhythmusstörungen beobachtet.
Die Anwendung von FANAPT sollte in Kombination mit anderen Arzneimitteln, von denen bekannt ist, dass sie die QTc verlängern, einschließlich Klasse 1A (z. B. Chinidin, Procainamid), vermieden werden. oder Antiarrhythmika der Klasse III (z.B. Amiodaron, Sotalol), Antipsychotika (z.B. Chlorpromazin, Thioridazin), Antibiotika (z.B. Gatifloxacin, Moxifloxacin) oder jede andere Klasse von Medikamenten, von denen bekannt ist, dass sie das QTc-Intervall verlängern (z.B. Pentamidin, Levomethadylacetat, Methadon). FANAPT sollte auch bei Patienten mit angeborenem langem QT-Syndrom und bei Patienten mit Herzrhythmusstörungen in der Anamnese vermieden werden.
Bestimmte Umstände können das Risiko von Torsade de Pointes und / oder plötzlichen Todesfällen in Verbindung mit der Einnahme von Arzneimitteln erhöhen, die das QTc-Intervall verlängern, einschließlich (1) Bradykardie; (2) Hypokaliämie oder Hypomagnesiämie; (3) gleichzeitige Anwendung anderer Arzneimittel, die das QTc-Intervall verlängern; und (4) Vorhandensein einer angeborenen Verlängerung des QT-Intervalls; (5) kürzlicher akuter Myokardinfarkt; und / oder (6) nicht kompensierte Herzinsuffizienz.
Vorsicht ist geboten, wenn FANAPT zusammen mit Arzneimitteln verschrieben wird, die den FANAPT-Metabolismus hemmen, sowie bei Patienten mit verminderter CYP2D6-Aktivität.
Es wird empfohlen, Patienten mit einem signifikanten Risiko für eine Behandlung mit FANAPT in Betracht zu ziehen Elektrolytstörungen haben Basisserum Kalium- und Magnesiummessungen mit periodischen Überwachung. Eine Hypokaliämie (und / oder Hypomagnesiämie) kann das Risiko einer QT-Verlängerung und einer Arrhythmie erhöhen. FANAPT sollte bei Patienten mit Anamnese einer signifikanten kardiovaskulären Erkrankung, z. B. QT, vermieden werden Verlängerung, kürzlicher akuter Myokardinfarkt, nicht kompensierte Herzinsuffizienz oder Herzrhythmusstörungen. Bei Patienten mit persistierenden QTc-Messungen> 500 ms sollte FANAPT abgesetzt werden.
Wenn bei Patienten, die FANAPT einnehmen, Symptome auftreten, die auf das Auftreten von Herzrhythmusstörungen hinweisen könnten, z. Bei Schwindel, Herzklopfen oder Synkope sollte der verschreibende Arzt eine weitere Untersuchung einleiten, einschließlich des Herzens Überwachung.
Malignes neuroleptisches Syndrom (NMS)
Ein potenziell tödlicher Symptomkomplex, der manchmal als malignes neuroleptisches Syndrom (NMS) bezeichnet wird, wurde im Zusammenhang mit der Verabreichung von Antipsychotika, einschließlich FANAPT, berichtet. Klinische Manifestationen umfassen Hyperpyrexie, Muskelsteifheit, veränderten Geisteszustand (einschließlich katatonischer Symptome) und Anzeichen einer autonomen Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzinfarkt) Dysrhythmie). Zusätzliche Anzeichen können erhöhte Kreatinphosphokinase, Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein. Die diagnostische Beurteilung von Patienten mit diesem Syndrom ist kompliziert. Um zu einer Diagnose zu gelangen, ist es wichtig, Fälle zu identifizieren, in denen die klinische Präsentation umfasst sowohl schwerwiegende Erkrankungen als auch unbehandelte oder unzureichend behandelte extrapyramidale Anzeichen und Symptome (EPS). Andere wichtige Überlegungen in der Differentialdiagnose umfassen die zentrale anticholinerge Toxizität, Hitzschlag, Drogenfieber und die Pathologie des primären Zentralnervensystems (ZNS).
Die Behandlung dieses Syndroms sollte umfassen: (1) sofortiges Absetzen der Antipsychotika und anderer Arzneimittel, die für die gleichzeitige Therapie nicht erforderlich sind; (2) Intensive symptomatische Behandlung und ärztliche Überwachung sowie (3) Behandlung von gleichzeitig auftretenden schwerwiegenden medizinischen Problemen, für die spezifische Behandlungen verfügbar sind. Es gibt keine allgemeine Übereinstimmung über spezifische pharmakologische Behandlungsschemata für NMS.
Wenn ein Patient nach der Genesung von NMS eine Behandlung mit Antipsychotika benötigt, sollte die mögliche Wiedereinführung der medikamentösen Therapie sorgfältig erwogen werden. Der Patient sollte sorgfältig überwacht werden, da über Rezidive von NMS berichtet wurde.
Spätdyskinesie
Tardive Dyskinesie ist ein Syndrom, das aus möglicherweise irreversiblen, unwillkürlichen dyskinetischen Bewegungen besteht, die bei mit Antipsychotika behandelten Patienten auftreten können. Obwohl die Prävalenz des Syndroms bei älteren Menschen, insbesondere bei älteren Frauen, am höchsten zu sein scheint, ist dies unmöglich stützen sich auf Prävalenzschätzungen, um zu Beginn der Behandlung mit Antipsychotika vorherzusagen, bei welchen Patienten die Krankheit wahrscheinlich auftritt Syndrom. Es ist nicht bekannt, ob Antipsychotika sich in ihrem Potenzial unterscheiden, eine Spätdyskinesie zu verursachen.
Man geht davon aus, dass das Risiko einer Spätdyskinesie und die Wahrscheinlichkeit, dass sie irreversibel wird, hoch ist die Behandlungsdauer und die kumulative Gesamtdosis des verabreichten Antipsychotikums zu erhöhen erhöht sich. Das Syndrom kann sich jedoch nach relativ kurzen Behandlungsperioden bei niedrigen Dosen entwickeln, wenn auch viel seltener.
Es ist keine Behandlung für etablierte Fälle von Spätdyskinesien bekannt, obwohl das Syndrom teilweise oder vollständig zurückgehen kann, wenn die antipsychotische Behandlung abgesetzt wird. Die antipsychotische Behandlung selbst kann jedoch die Anzeichen und Symptome des Syndroms unterdrücken (oder teilweise unterdrücken) und dadurch möglicherweise den zugrunde liegenden Prozess maskieren. Die Wirkung der symptomatischen Unterdrückung auf den Langzeitverlauf des Syndroms ist nicht bekannt.
Angesichts dieser Überlegungen sollte FANAPT so verschrieben werden, dass das Auftreten von Spätdyskinesien mit größter Wahrscheinlichkeit minimiert wird. Die Behandlung mit chronischen Antipsychotika sollte im Allgemeinen Patienten vorbehalten sein, die an einer chronischen Krankheit leiden, von der bekannt ist, dass sie auf (1) anspricht Antipsychotika, und (2) für die alternative, gleich wirksame, aber möglicherweise weniger schädliche Behandlungen nicht verfügbar sind oder angemessen. Bei Patienten, die eine chronische Behandlung benötigen, sollte nach der kleinsten Dosis und der kürzesten Behandlungsdauer gesucht werden, die zu einem zufriedenstellenden klinischen Ansprechen führen. Die Notwendigkeit einer weiteren Behandlung sollte regelmäßig überprüft werden.
Wenn bei einem Patienten unter FANAPT Anzeichen und Symptome einer Spätdyskinesie auftreten, sollte ein Absetzen des Arzneimittels in Betracht gezogen werden. Bei einigen Patienten kann jedoch trotz des Vorhandenseins des Syndroms eine Behandlung mit FANAPT erforderlich sein.
Stoffwechselveränderungen
Atypische Antipsychotika wurden mit Stoffwechselveränderungen in Verbindung gebracht, die das kardiovaskuläre / zerebrovaskuläre Risiko erhöhen können. Diese metabolischen Veränderungen umfassen Hyperglykämie, Dyslipidämie und Körpergewichtszunahme. Während gezeigt wurde, dass alle atypischen Antipsychotika einige Stoffwechselveränderungen hervorrufen, hat jedes Medikament in der Klasse sein eigenes spezifisches Risikoprofil.
Hyperglykämie und Diabetes mellitus
Bei Patienten, die mit atypischen Antipsychotika, einschließlich FANAPT, behandelt wurden, wurde über Hyperglykämie berichtet, die in einigen Fällen extrem war und mit Ketoazidose, hyperosmolarem Koma oder Tod einherging. Die Bewertung des Zusammenhangs zwischen atypischer antipsychotischer Anwendung und Glukoseabnormalitäten wird durch die Möglichkeit einer Zunahme erschwert Hintergrundrisiko für Diabetes mellitus bei Patienten mit Schizophrenie und zunehmender Inzidenz von Diabetes mellitus im Allgemeinen Population. Angesichts dieser Störfaktoren ist der Zusammenhang zwischen atypischer antipsychotischer Anwendung und durch Hyperglykämie bedingten unerwünschten Ereignissen nicht vollständig geklärt. Epidemiologische Studien deuten jedoch auf ein erhöhtes Risiko von Hyperglykämie-bedingten unerwünschten Ereignissen bei Patienten hin, die mit den in diesen Studien enthaltenen atypischen Antipsychotika behandelt wurden.
Patienten mit einer nachgewiesenen Diagnose von Diabetes mellitus, die mit atypischen Antipsychotika behandelt werden, sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten mit Risikofaktoren für Diabetes mellitus (z. B. Fettleibigkeit, familiäre Zuckerkrankheit), mit denen die Behandlung beginnt atypische Antipsychotika sollten zu Beginn der Behandlung und in regelmäßigen Abständen während der Behandlung einer Blutzuckermessung unterzogen werden Behandlung. Jeder mit atypischen Antipsychotika behandelte Patient sollte auf Symptome einer Hyperglykämie überwacht werden, einschließlich Polydipsie, Polyurie, Polyphagie und Schwäche. Patienten, bei denen während der Behandlung mit atypischen Antipsychotika Symptome einer Hyperglykämie auftreten, sollten sich einer Blutzuckermessung unterziehen. In einigen Fällen ist die Hyperglykämie abgeklungen, als das atypische Antipsychotikum abgesetzt wurde. Einige Patienten benötigten jedoch trotz Absetzen des verdächtigen Arzneimittels eine Fortsetzung der Behandlung mit Antidiabetika.
Die Daten einer vierwöchigen Studie mit fester Dosis bei erwachsenen Personen mit Schizophrenie, bei der Nüchternblutproben entnommen wurden, sind in Tabelle 1 aufgeführt.
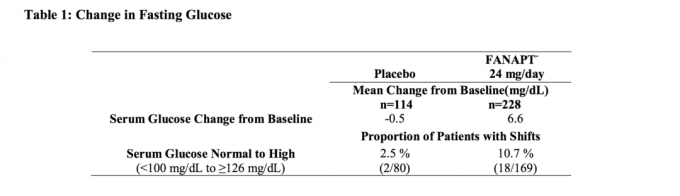
Gepoolte Analysen von Glucosedaten aus klinischen Studien, einschließlich längerfristiger Studien, sind in Tabelle 2 gezeigt.
Dyslipidämie
Bei Patienten, die mit atypischen Antipsychotika behandelt wurden, wurden unerwünschte Veränderungen der Lipide beobachtet.
Die Daten einer placebokontrollierten 4-wöchigen Studie mit fester Dosis, in der Nüchternblutproben entnommen wurden, bei erwachsenen Probanden mit Schizophrenie sind in Tabelle 3 dargestellt.

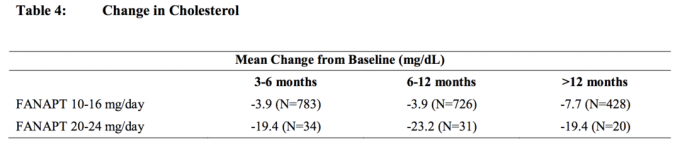
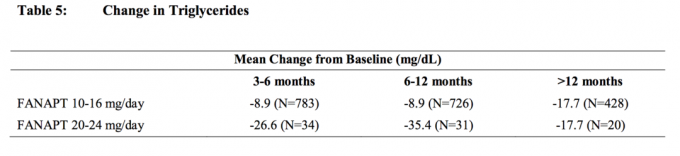
Gepoolte Analysen von Cholesterin- und Triglyceriddaten aus klinischen Studien, einschließlich Langzeitstudien, sind in Tabelle 4 und Tabelle 5 aufgeführt.
Gewichtszunahme
Bei atypischer antipsychotischer Anwendung wurde eine Gewichtszunahme beobachtet. Die klinische Überwachung des Gewichts wird empfohlen.
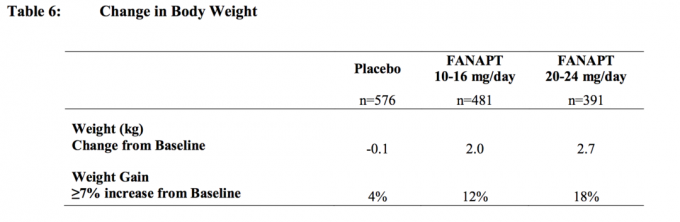
In allen Kurz- und Langzeitstudien betrug die durchschnittliche Veränderung gegenüber dem Ausgangswert am Endpunkt insgesamt 2,1 kg.
Veränderungen des Körpergewichts (kg) und des Anteils der Probanden mit ≥7% Körpergewichtszunahme ab 4 placebokontrollierte 4- oder 6-wöchige Studien mit fester oder flexibler Dosis an erwachsenen Probanden werden in vorgestellt Tabelle 6.
Anfälle
In placebokontrollierten Kurzzeitstudien (4 bis 6 Wochen) traten bei 0,1% (1/1344) der mit FANAPT behandelten Patienten Anfälle auf, verglichen mit 0,3% (2/587) unter Placebo. Wie bei anderen Antipsychotika sollte FANAPT bei Patienten mit Anfällen in der Anamnese oder bei Erkrankungen, die möglicherweise die Anfallsschwelle senken, mit Vorsicht angewendet werden. Erkrankungen, die die Anfallsschwelle senken, treten möglicherweise häufiger bei einer Bevölkerung von 65 Jahren oder älter auf.
Orthostatische Hypotonie und Synkope
FANAPT kann eine orthostatische Hypotonie auslösen, die mit Schwindel, Tachykardie und Synkope einhergeht. Dies spiegelt seine alpha1-adrenergen Antagonisten-Eigenschaften wider. In doppelblinden, placebokontrollierten Kurzzeitstudien, in denen die Dosis wie empfohlen langsam erhöht wurde Oben wurde bei 0,4% (5/1344) der mit FANAPT behandelten Patienten von einer Synkope berichtet, verglichen mit 0,2% (1/587) am Placebo. Orthostatische Hypotonie wurde bei 5% der Patienten mit 20-24 mg / Tag, bei 3% der Patienten mit 10-16 mg / Tag und bei 1% der Patienten mit Placebo berichtet. Eine schnellere Titration dürfte die Rate der orthostatischen Hypotonie und der Synkope erhöhen.
FANAPT sollte bei Patienten mit bekannten kardiovaskulären Erkrankungen (z. B. Herzinsuffizienz, Myokardinfarkt in der Anamnese, Ischämie oder Überleitung) mit Vorsicht angewendet werden Anomalien), zerebrovaskuläre Erkrankungen oder Zustände, die den Patienten für eine Hypotonie prädisponieren (Dehydration, Hypovolämie und Behandlung mit Antihypertensiva) Medikamente). Bei Patienten, die anfällig für Hypotonie sind, sollte die Überwachung der orthostatischen Vitalfunktionen in Betracht gezogen werden.
Leukopenie, Neutropenie und Agranulozytose
In klinischen Studien und nach Markteinführung wurden Fälle von Leukopenie / Neutropenie berichtet, die zeitlich mit Antipsychotika zusammenhängen. Es wurde auch über Agranulozytose (einschließlich tödlicher Fälle) berichtet.
Mögliche Risikofaktoren für Leukopenie / Neutropenie sind eine bereits bestehende niedrige Anzahl weißer Blutkörperchen (WBC) und die Vorgeschichte einer durch Arzneimittel verursachten Leukopenie / Neutropenie. Patienten mit einem vorbestehenden niedrigen WBC oder einer Vorgeschichte von arzneimittelinduzierter Leukopenie / Neutropenie sollten ihr komplettes Blutbild (CBC) überwachen lassen häufig in den ersten Monaten der Therapie und sollte FANAPT beim ersten Anzeichen eines Rückgangs der Leukozytenzahl abbrechen, wenn kein anderer Erreger vorliegt Faktoren.
Patienten mit Neutropenie sollten sorgfältig auf Fieber oder andere Symptome oder Anzeichen einer Infektion überwacht und unverzüglich behandelt werden, wenn solche Symptome oder Anzeichen auftreten. Patienten mit schwerer Neutropenie (absolute Neutrophilenzahl <1000 / mm3) sollten FANAPT absetzen und ihr WBC bis zur Genesung verfolgen lassen.
Hyperprolaktinämie
Wie bei anderen Arzneimitteln, die Dopamin-D2-Rezeptoren antagonisieren, erhöht FANAPT den Prolaktinspiegel.
Hyperprolaktinämie kann hypothalamisches GnRH unterdrücken, was zu einer verringerten Hypophysen-Gonadotropin-Sekretion führt. Dies kann wiederum die Fortpflanzungsfunktion beeinträchtigen, indem die Gonadalsteroidogenese sowohl bei weiblichen als auch bei männlichen Patienten beeinträchtigt wird. Über Galaktorrhoe, Amenorrhoe, Gynäkomastie und Impotenz wurde bei prolaktinsteigernden Verbindungen berichtet. Eine lang anhaltende Hyperprolaktinämie in Verbindung mit Hypogonadismus kann sowohl bei weiblichen als auch bei männlichen Patienten zu einer verminderten Knochendichte führen.
Gewebekulturexperimente zeigen, dass ungefähr ein Drittel der menschlichen Brustkrebserkrankungen in vitro prolaktinabhängig sind, a Faktor von potenzieller Bedeutung, wenn die Verschreibung dieser Medikamente bei einer Patientin mit zuvor erkannter Brust in Betracht gezogen wird Krebs. Bei Mäusen und Ratten, die mit FANAPT behandelt wurden, wurden proliferative Veränderungen der Milchdrüse und ein Anstieg des Serumprolaktins beobachtet. Weder klinische Studien noch epidemiologische Studien, die bisher durchgeführt wurden, haben einen Zusammenhang zwischen der chronischen Verabreichung dieser Wirkstoffklasse und der Tumorentstehung beim Menschen gezeigt. Die verfügbaren Beweise sind zu begrenzt, um zum jetzigen Zeitpunkt schlüssig zu sein.
In einer placebokontrollierten Kurzzeitstudie (4 Wochen) änderte sich der Mittelwert der Plasmapolaktinspiegel vom Ausgangswert zum Endpunkt Für die mit FANAPT 24 mg / Tag behandelte Gruppe war eine Zunahme von 2,6 ng / ml im Vergleich zu einer Abnahme von 6,3 ng / ml in der Gruppe zu verzeichnen Placebo-Gruppe. In dieser Studie wurden bei 26% der mit FANAPT behandelten Erwachsenen erhöhte Plasma-Prolaktinspiegel beobachtet, verglichen mit 12% in der Placebogruppe. In den Kurzzeitstudien war FANAPT mit einem geringen Prolaktinanstieg verbunden, verglichen mit einem höheren Prolaktinanstieg, der bei einigen anderen Antipsychotika beobachtet wurde. In gepoolten Analysen aus klinischen Studien, einschließlich längerfristiger Studien, wurde bei 3210 mit Iloperidon behandelten Erwachsenen bei 2 männlichen Probanden (0,1%) über Gynäkomastie berichtet. Im Vergleich zu 0% bei Placebo-behandelten Patienten wurde bei 8 weiblichen Probanden (0,2%) Galaktorrhoe berichtet, im Vergleich zu 3 weiblichen Probanden (0,5%) bei Placebo-behandelten Patienten.
Regulierung der Körpertemperatur
Die Störung der Fähigkeit des Körpers, die Körpertemperatur zu senken, wurde auf Antipsychotika zurückgeführt. Bei der Verschreibung von FANAPT für Patienten, bei denen Erkrankungen auftreten, die zu einer Erhöhung des Körperkerns beitragen können, ist eine angemessene Vorsicht geboten B. anstrengendes Training, Exposition gegenüber extremer Hitze, gleichzeitige Einnahme von Medikamenten mit anticholinerger Wirkung oder Belastung Austrocknung.
Dysphagie
Dysmotilität und Aspiration der Speiseröhre wurden mit dem Konsum von Antipsychotika in Verbindung gebracht. Aspirationspneumonie ist eine häufige Ursache für Morbidität und Mortalität bei älteren Patienten. FANAPT und andere Antipsychotika sollten bei Patienten, bei denen das Risiko einer Aspirationspneumonie besteht, mit Vorsicht angewendet werden.
Selbstmord
Die Möglichkeit eines Selbstmordversuchs ist mit einer psychotischen Erkrankung verbunden, und eine engmaschige Überwachung von Hochrisikopatienten sollte die medikamentöse Therapie begleiten. Rezepte für FANAPT sollten für die kleinste Menge Tabletten in Übereinstimmung mit einer guten Patientenbehandlung geschrieben werden, um das Risiko einer Überdosierung zu verringern.
Priapismus
Drei Fälle von Priapismus wurden im FANAPT-Programm vor der Markteinführung gemeldet. Es wurde berichtet, dass Arzneimittel mit alpha-adrenerger Blockierungswirkung Priapismus hervorrufen. FANAPT teilt diese pharmakologische Aktivität. Bei schwerem Priapismus kann ein chirurgischer Eingriff erforderlich sein.
Potenzial für kognitive und motorische Beeinträchtigungen
Wie andere Antipsychotika kann FANAPT das Urteilsvermögen, das Denken oder die motorischen Fähigkeiten beeinträchtigen. In placebokontrollierten Kurzzeitstudien wurde in 11,9% (104/874) von Schläfrigkeit (einschließlich Sedierung) berichtet Erwachsene Patienten, die mit FANAPT in Dosen von 10 mg / Tag oder mehr behandelt wurden, versus 5,3% (31/587), die mit FANAPT behandelt wurden Placebo. Patienten sollten vor dem Bedienen gefährlicher Maschinen, einschließlich Autos, gewarnt werden, bis sie hinreichend sicher sind, dass die Therapie mit FANAPT keine nachteiligen Auswirkungen auf sie hat.
oben
Nebenwirkungen
Erfahrung in klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, werden bei der klinischen Prüfung eines Arzneimittels unerwünschte Reaktionen beobachtet kann nicht direkt mit den Raten in klinischen Studien mit einem anderen Arzneimittel verglichen werden und spiegelt möglicherweise nicht die in klinischen Studien beobachteten Raten wider trainieren. Die folgenden Informationen stammen aus einer Datenbank für klinische Studien mit FANAPT, die 3229 Patienten umfasst, die FANAPT in Dosen von 10 mg / Tag oder mehr zur Behandlung von Schizophrenie ausgesetzt waren. Von diesen erhielten 999 mindestens 6 Monate lang FANAPT, während 657 mindestens 12 Monate lang FANAPT ausgesetzt waren. Alle diese Patienten, die FANAPT erhielten, nahmen an klinischen Studien mit mehreren Dosen teil. Die Bedingungen und die Dauer der Behandlung mit FANAPT waren sehr unterschiedlich und umfassten (in überlappenden Kategorien) Open-Label- und Doppelblinde Studienphasen, stationäre und ambulante Studien, Studien mit fester und flexibler Dosis sowie Kurzzeit- und Langzeitstudien Exposition.
Die in diesen Abschnitten präsentierten Informationen wurden aus gepoolten Daten von 4 placebokontrollierten, 4- oder 6-wöchigen, Studien mit fester oder flexibler Dosis bei Patienten, die FANAPT in Tagesdosen im Bereich von 10 bis 24 mg erhielten (n = 874).
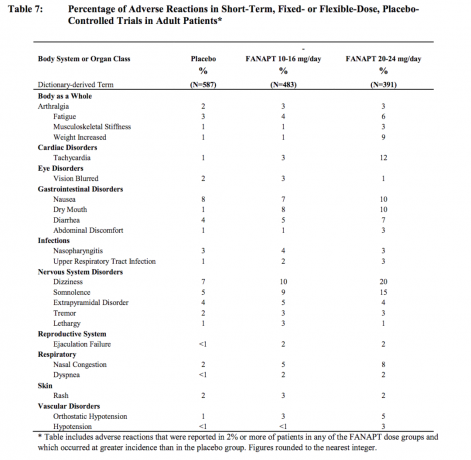
Nebenwirkungen, die bei mit FANAPT behandelten Patienten mit einer Inzidenz von 2% oder mehr und häufiger als bei Placebo auftreten
Tabelle 7 listet die zusammengefassten Inzidenzen von Nebenwirkungen auf, die spontan in vier placebokontrollierten, 4- oder 6-wöchigen, Studien mit fester oder flexibler Dosis, in denen die Reaktionen aufgeführt sind, die bei 2% oder mehr der mit FANAPT behandelten Patienten in einer der Dosierungen auftraten und bei denen die Inzidenz bei mit FANAPT behandelten Patienten in jeder Dosisgruppe höher war als die Inzidenz bei mit FANAPT behandelten Patienten Placebo.
Dosisabhängige Nebenwirkungen in klinischen Studien
Basierend auf den gepoolten Daten aus 4 placebokontrollierten 4- oder 6-wöchigen Studien mit fester oder flexibler Dosis traten Nebenwirkungen mit mehr als 2% auf. Die Inzidenz bei Patienten, die mit FANAPT behandelt wurden und bei denen die Inzidenz bei Patienten, die mit FANAPT behandelt wurden, 20-24 mg / Tag doppelt so hoch war wie die Inzidenz bei Patienten, die mit FANAPT 10-16 mg / Tag behandelt wurden, waren: Bauchbeschwerden, Schwindel, Hypotonie, Muskel-Skelett-Steifheit, Tachykardie und Gewicht ist gestiegen.
Häufige und arzneimittelbedingte Nebenwirkungen in klinischen Studien
Basierend auf den gesammelten Daten aus 4 placebokontrollierten 4- oder 6-wöchigen Studien mit fester oder flexibler Dosis traten die folgenden Nebenwirkungen bei den behandelten Patienten mit einer Inzidenz von ≥ 5% auf mit FANAPT und mindestens der doppelten Menge Placebo bei mindestens 1 Dosis: Schwindel, Mundtrockenheit, Müdigkeit, verstopfte Nase, Schläfrigkeit, Tachykardie, orthostatische Hypotonie und Gewicht ist gestiegen. Schwindel, Tachykardie und Gewichtszunahme waren bei 20-24 mg / Tag mindestens doppelt so häufig wie bei 10-16 mg / Tag.
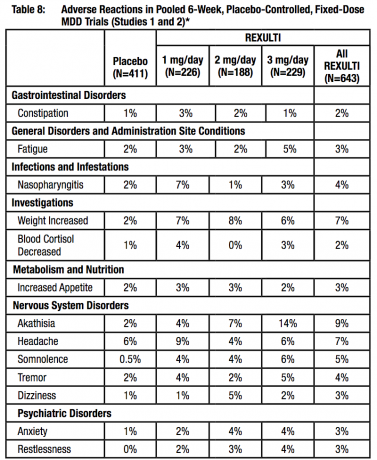
Extrapyramidale Symptome (EPS) in klinischen Studien
Die gepoolten Daten aus den 4 placebokontrollierten 4- oder 6-wöchigen Studien mit fester oder flexibler Dosis lieferten Informationen zu EPS. Daten zu unerwünschten Ereignissen, die aus diesen Studien gesammelt wurden, zeigten die folgenden Raten von EPS-bezogenen unerwünschten Ereignissen, wie in Tabelle 8 gezeigt.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in klinischen Studien
Basierend auf den gepoolten Daten aus 4 placebokontrollierten, 4- oder 6-wöchigen, fixen oder flexiblen Dosierungsstudien gab es keine Unterschied in der Häufigkeit eines Absetzens aufgrund unerwünschter Ereignisse zwischen FANAPT-behandelt (5%) und Placebo-behandelt (5%) Patienten. Die Arten von unerwünschten Ereignissen, die zum Absetzen führten, waren bei den mit FANAPT und Placebo behandelten Patienten ähnlich.
Demografische Unterschiede bei Nebenwirkungen in klinischen Studien
Eine Untersuchung von Bevölkerungsuntergruppen in den 4 placebokontrollierten, 4- oder 6-wöchigen, fixen oder Studien mit flexibler Dosierung ergaben keine Hinweise auf Unterschiede in der Sicherheit in Bezug auf das Alter. Geschlecht oder Rasse.
Laborteststörungen in klinischen Studien
Es gab keine Unterschiede zwischen FANAPT und Placebo in Bezug auf die Häufigkeit des Absetzens aufgrund von Veränderungen in der Hämatologie, der Urinanalyse oder der Serumchemie.
In placebokontrollierten Kurzzeitstudien (4-6 Wochen) gab es 1,0% (13/1342) mit Iloperidon behandelte Patienten mit Hämatokrit mindestens ein Mal unter dem erweiterten Normalbereich während der Behandlung nach Randomisierung, verglichen mit 0,3% (2/585) nach Placebo. Der erweiterte Normalbereich für erniedrigtes Hämatokrit wurde in jedem dieser Versuche als Wert definiert, der 15% unter dem Normalbereich für das in dem Versuch verwendete zentrale Labor lag.
Andere Reaktionen während der Evaluierung von FANAPT vor dem Inverkehrbringen
Das Folgende ist eine Liste von MedDRA-Begriffen, die Nebenwirkungen bei mit FANAPT behandelten Patienten widerspiegeln bei Mehrfachdosen ≥ 4 mg / Tag während einer beliebigen Phase einer Studie mit der Datenbank von 3210 FANAPT-behandelten Patienten. Alle gemeldeten Reaktionen sind eingeschlossen, mit Ausnahme der in Tabelle 7 bereits aufgelisteten oder anderer Teile der Nebenwirkungen (6), die in der Tabelle 1 berücksichtigt sind Warnhinweise und Vorsichtsmaßnahmen (5), die als nicht aussagekräftig eingestuften Reaktionsbegriffe, die bei weniger als 3 Patienten auftraten und bei denen waren weder schwerwiegend noch lebensbedrohlich, Reaktionen, die ansonsten als Hintergrundreaktionen üblich sind, und Reaktionen, die als unwahrscheinlich eingestuft werden verbunden.
Die Reaktionen werden weiter nach MedDRA-Systemorganklassen kategorisiert und nach abnehmender Häufigkeit wie folgt aufgelistet Definitionen: Häufige unerwünschte Ereignisse treten bei mindestens 1/100 Patienten auf (nur die in Tabelle 7 nicht aufgeführten sind in dieser Tabelle aufgeführt) Auflistung); seltene Nebenwirkungen treten bei 1/100 bis 1/1000 Patienten auf; seltene Ereignisse treten bei weniger als 1/1000 Patienten auf.
Blut- und Lymphstörungen: selten - Anämie, Eisenmangelanämie; Selten-Leukopenie
Herzerkrankungen: häufig - Herzklopfen; Selten - Arrhythmie, atrioventrikuläre Blockade ersten Grades, Herzinsuffizienz (einschließlich kongestiver und akuter)
Erkrankungen des Ohrs und des Labyrinths: In seltenen Fällen - Schwindel, Tinnitus
Endokrine Störungen: Selten - Hypothyreose
Augenerkrankungen: Häufig - Bindehautentzündung (einschließlich allergischer); Selten - trockenes Auge, Blepharitis, Augenlidödem, Schwellung der Augen, Trübung der Linsen, Katarakt, Hyperämie (einschließlich Bindehautentzündung)
Gastrointestinale Störungen: Selten - Gastritis, Speichelhypersekretion, Stuhlinkontinenz, Mundgeschwüre; Selten - aphthöse Stomatitis, Zwölffingerdarmgeschwür, Hiatushernie, Hyperchlorhydrie, Lippengeschwür, Refluxösophagitis, Stomatitis
Allgemeine Erkrankungen und Beschwerden am Verwaltungsstandort: Selten - Ödeme (allgemein, Lochfraß aufgrund von Herzerkrankungen), Schwierigkeiten beim Gehen, Durst; Selten - Hyperthermie
Hepatobiliäre Störungen: selten - Cholelithiasis
Untersuchungen: Häufig: Gewichtsabnahme; Selten - Hämoglobin nahm ab, die Neutrophilenzahl nahm zu, der Hämatokrit nahm ab
Stoffwechsel- und Ernährungsstörungen: Selten - erhöhter Appetit, Dehydration, Hypokaliämie, Flüssigkeitsretention
Erkrankungen des Bewegungsapparates und des Bindegewebes: Häufig - Myalgie, Muskelkrämpfe; Selten - Torticollis
Erkrankungen des Nervensystems: seltene Parästhesien, psychomotorische Hyperaktivität, Unruhe, Amnesie, Nystagmus; Selten - Restless Legs Syndrom
Psychiatrische Störungen: Häufig - Unruhe, Aggression, Wahn; Selten - Feindseligkeit, verminderte Libido, Paranoia, Anorgasmie, Verwirrtheit, Manie, Katatonie, Stimmungsschwankungen, Panik Attacke, Zwangsstörung, Bulimia nervosa, Delirium, Polydipsie psychogen, Impulskontrollstörung, Major Depression
Erkrankungen der Nieren und Harnwege: Häufig - Harninkontinenz; Selten - Dysurie, Pollakisurie, Enuresis, Nephrolithiasis; Selten - Harnverhaltung, akutes Nierenversagen
Fortpflanzungssystem und Bruststörungen: Häufig - erektile Dysfunktion; Selten - Hodenschmerzen, Amenorrhoe, Brustschmerzen; Selten - unregelmäßige Menstruation, Gynäkomastie, Menorrhagie, Metrorrhagie, postmenopausale Blutung, Prostatitis.
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: selten - Epistaxis, Asthma, Rhinorrhoe, Verstopfung der Nasennebenhöhlen, Trockenheit der Nase; Selten - trockener Hals, Schlafapnoe-Syndrom, Atemnot anstrengend
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von FANAPT nach der Zulassung festgestellt: retrograde Ejakulation und Überempfindlichkeitsreaktionen (einschließlich Anaphylaxie; Angioödem; Engegefühl im Hals; oropharyngeale Schwellung; Schwellung von Gesicht, Lippen, Mund und Zunge; Urtikaria; Ausschlag; und Juckreiz). Da diese Reaktionen freiwillig von einer Population ungewisser Größe gemeldet wurden, ist es nicht möglich, deren Häufigkeit zuverlässig abzuschätzen oder einen ursächlichen Zusammenhang mit der Arzneimittelexposition herzustellen.
oben
Wechselwirkungen mit anderen Medikamenten
Angesichts der primären ZNS-Wirkungen von FANAPT ist Vorsicht geboten, wenn es in Kombination mit anderen zentral wirkenden Drogen und Alkohol eingenommen wird. Aufgrund seines - alpha1-adrenergen Rezeptorantagonismus kann FANAPT die Wirkung bestimmter blutdrucksenkender Mittel verstärken.
Mögliche Auswirkungen anderer Medikamente auf FANAPT
Iloperidon ist kein Substrat für die Enzyme CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 oder CYP2E1. Dies legt nahe, dass eine Wechselwirkung von Iloperidon mit Inhibitoren oder Induktoren dieser Enzyme oder anderen Faktoren wie Rauchen unwahrscheinlich ist. Sowohl CYP3A4 als auch CYP2D6 sind für den Iloperidonstoffwechsel verantwortlich. Inhibitoren von CYP3A4 (z. B. Ketoconazol) oder CYP2D6 (z. B. Fluoxetin, Paroxetin) können die Elimination von Iloperidon hemmen und erhöhte Blutspiegel verursachen.
Ketoconazol: Die gleichzeitige Anwendung von Ketoconazol (200 mg zweimal täglich über 4 Tage), einem wirksamen CYP3A4-Inhibitor, mit einer Einzeldosis von 3 mg Iloperidon zu 19 gesunde Probanden im Alter von 18 bis 45 Jahren vergrößerten die Fläche unter der Kurve (AUC) von Iloperidon und seinen Metaboliten P88 und P95 um 57%, 55% und 35%. beziehungsweise. Die Iloperidon-Dosen sollten um etwa die Hälfte reduziert werden, wenn Ketoconazol oder andere starke CYP3A4-Inhibitoren (z. B. Itraconazol) verabreicht werden. Schwächere Inhibitoren (z. B. Erythromycin, Grapefruitsaft) wurden nicht untersucht. Wenn der CYP3A4-Hemmer aus der Kombinationstherapie genommen wird, sollte die Iloperidon-Dosis auf das vorherige Niveau zurückgesetzt werden.
Fluoxetin: gleichzeitige Verabreichung von Fluoxetin (20 mg zweimal täglich über 21 Tage), einem wirksamen CYP2D6-Hemmer, mit einer Einzeldosis von 3 mg Iloperidon an 23 gesunde Probanden im Alter von 29 bis 44 Jahren. die als CYP2D6-Metabolisierer klassifiziert wurden, erhöhten die AUC von Iloperidon und seinem Metaboliten P88 um das 2- bis 3-fache und verringerten die AUC seines Metaboliten P95 um eine Hälfte. Bei Gabe von Fluoxetin sollten die Iloperidon-Dosen um die Hälfte reduziert werden. Wenn Fluoxetin aus der Kombinationstherapie genommen wird, sollte die Iloperidon-Dosis auf das vorherige Niveau zurückgesetzt werden. Bei anderen starken CYP2D6-Inhibitoren ist zu erwarten, dass sie ähnliche Wirkungen haben und eine angemessene Dosisreduktion erfordern. Wenn der CYP2D6-Inhibitor aus der Kombinationstherapie genommen wird, könnte die Iloperidon-Dosis auf das vorherige Niveau erhöht werden.
Paroxetin: gleichzeitige Verabreichung von Paroxetin (20 mg / Tag für 5 bis 8 Tage), einem wirksamen CYP2D6-Hemmer, mit mehreren Dosen Iloperidon (8 oder 12 mg zweimal täglich) bei Patienten mit Schizophrenie im Alter von 18-65 Jahren führten zu erhöhten mittleren Steady-State-Spitzenkonzentrationen von Iloperidon und sein Metabolit P88 um das 1,6-fache und verringerten die mittleren Steady-State-Spitzenkonzentrationen seines Metaboliten P95 um eine Hälfte. Bei Gabe von Paroxetin sollten die Iloperidon-Dosen um die Hälfte reduziert werden. Wenn Paroxetin aus der Kombinationstherapie genommen wird, sollte die Iloperidon-Dosis auf das vorherige Niveau zurückgesetzt werden. Bei anderen starken CYP2D6-Inhibitoren ist zu erwarten, dass sie ähnliche Wirkungen haben und eine angemessene Dosisreduktion erfordern. Wenn der CYP2D6-Hemmer aus der Kombinationstherapie genommen wird, kann die Iloperidon-Dosis auf die vorherigen Werte erhöht werden.
Paroxetin und Ketoconazol: gleichzeitige Verabreichung von Paroxetin (20 mg einmal täglich über 10 Tage), einem CYP2D6-Inhibitor und Ketoconazol (200 mg) zweimal täglich) mit mehreren Dosen von Iloperidon (8 oder 12 mg zweimal täglich) bei Patienten mit Schizophrenie im Alter von 18 bis 65 Jahren führte zu einer 1,4 Anstieg der Steady-State-Konzentrationen von Iloperidon und seinem Metaboliten P88 um das 1,4-fache und Abnahme des P95 in Gegenwart von Paroxetin. Daher trug die Gabe von Iloperidon mit Inhibitoren beider Stoffwechselwege nicht zur Wirkung eines der beiden allein verabreichten Inhibitoren bei. Iloperidon-Dosen sollten daher um etwa die Hälfte reduziert werden, wenn sie gleichzeitig mit einem CYP2D6- und einem CYP3A4-Inhibitor verabreicht werden.
Potenzielle Auswirkungen von FANAPT auf andere Medikamente
In-vitro-Studien an menschlichen Lebermikrosomen zeigten, dass Iloperidon den Metabolismus von nicht wesentlich hemmt Arzneimittel, die durch die folgenden Cytochrom P450-Isozyme metabolisiert werden: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 oder CYP2E1. In-vitro-Studien an menschlichen Lebermikrosomen zeigten außerdem, dass Iloperidon keine enzyminduzierenden Eigenschaften aufweist Eigenschaften, speziell für die folgenden Cytochrom P450-Isozyme: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 und CYP3A5.
Dextromethorphan: Eine Studie an gesunden Probanden zeigte, dass sich die Pharmakokinetik von Dextromethorphan (80 mg Dosis) bei einer Dosis von 3 mg ändert Die gleichzeitige Gabe von Iloperidon führte zu einer Erhöhung der Gesamtexposition um 17% und einer Erhöhung der maximalen Plasmakonzentration von C max um 26% Dextromethorphan. Daher ist eine Wechselwirkung zwischen Iloperidon und anderen CYP2D6-Substraten unwahrscheinlich.
Fluoxetin: Eine Einzeldosis von 3 mg Iloperidon hatte keinen Einfluss auf die Pharmakokinetik von Fluoxetin (20 mg zweimal täglich).
Midazolam (ein empfindliches CYP 3A4-Substrat): Eine Studie bei Patienten mit Schizophrenie zeigte einen Anstieg der Midazolam-Gesamtmenge um weniger als 50% Exposition bei Iloperidon im Steady State (14 Tage orale Gabe von bis zu 10 mg Iloperidon zweimal täglich) und keine Auswirkung auf Midazolam C max. Daher ist eine Wechselwirkung zwischen Iloperidon und anderen CYP3A4-Substraten unwahrscheinlich.
Arzneimittel, die das QT-Intervall verlängern FANAPT darf nicht zusammen mit anderen Arzneimitteln angewendet werden, die das QT-Intervall verlängern.
oben
Verwendung in bestimmten Populationen
Schwangerschaftsregister
Es gibt ein Schwangerschaftsregister, das die Schwangerschaftsergebnisse bei Frauen überwacht, die während der Schwangerschaft FANAPT ausgesetzt waren. Für weitere Informationen wenden Sie sich an das nationale Schwangerschaftsregister für atypische Antipsychotika unter 1-866-961-2388 oder besuchen Sie http://womensmentalhealth.org/clinical-and -Forschungsprogramme / Schwangerschaftsregistrierung /.
Risikoübersicht
Neugeborene, deren Mütter im dritten Trimenon der Schwangerschaft Antipsychotika, einschließlich FANAPT, ausgesetzt sind, sind nach der Entbindung einem Risiko für extrapyramidale und / oder Entzugssymptome ausgesetzt. Die begrenzten verfügbaren Daten zu FANAPT bei schwangeren Frauen reichen nicht aus, um ein drogenbedingtes Risiko für schwerwiegende Geburtsfehler und Fehlgeburten zu ermitteln. Iloperidon war bei oraler Verabreichung an trächtige Ratten während der Organogenese in Dosen bis zum 26-fachen der maximalen empfohlenen menschlichen Dosis von 24 mg / Tag, bezogen auf mg / m², nicht teratogen. Es verlängerte jedoch die Dauer der Schwangerschaft und der Geburt, erhöhte Totgeburten, frühen intrauterinen Todesfälle, erhöhte Inzidenz von Entwicklungsverzögerungen und verringerte das Überleben der Welpen nach der Geburt. Iloperidon war bei oraler Verabreichung an trächtige Kaninchen während der Organogenese in Dosen bis zum 20-fachen der MRHD auf mg / m²-Basis nicht teratogen. Es erhöhte jedoch den frühen intrauterinen Tod und verringerte die Lebensfähigkeit des Fötus zum Zeitpunkt der höchsten Dosis, die ebenfalls eine maternaltoxische Dosis war.
Das Hintergrundrisiko für schwerwiegende Geburtsfehler und Fehlgeburten bei der angegebenen Population ist nicht bekannt. In der US-amerikanischen Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwerwiegende Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2 bis 4% bzw. 15 bis 20%.
Klinische Überlegungen
Fetale / Neugeborene Nebenwirkungen
Extrapyramidale und / oder Entzugssymptome, einschließlich Erregung, Hypertonie, Hypotonie, Zittern, Schläfrigkeit, Atemnot und Fütterungsstörungen wurden bei Neugeborenen berichtet, deren Mütter im dritten Trimenon des Jahres 2004 Antipsychotika ausgesetzt waren Schwangerschaft. Diese Symptome waren unterschiedlich ausgeprägt. Einige Neugeborene erholten sich innerhalb von Stunden oder Tagen ohne besondere Behandlung. andere erforderten einen längeren Krankenhausaufenthalt. Neugeborene auf extrapyramidale und / oder Entzugssymptome überwachen und Symptome angemessen behandeln.
Daten
Tierdaten
In einer embryo-fetalen Entwicklungsstudie erhielten trächtige Ratten das 4, 16 oder 64 mg / kg / Tag (1,6, 6,5 und 26-fache der Dosis) empfohlene Höchstdosis (MRHD) von 24 mg / Tag (bezogen auf mg / m2) Iloperidon oral während des Zeitraums von Organogenese. Die höchste Dosis verursachte erhöhte frühe intrauterine Todesfälle, verringerte das Gewicht und die Länge des Fötus. verminderte Ossifikation des fetalen Skeletts und erhöhte Inzidenz von geringfügigen Anomalien des fetalen Skeletts und Variationen; Diese Dosis verursachte auch eine verringerte Nahrungsaufnahme und Gewichtszunahme der Mutter.
In einer embryo-fetalen Entwicklungsstudie erhielten trächtige Kaninchen während des Zeitraums der Organogenese 4, 10 oder 25 mg / kg / Tag (3, 8 und 20-fache MRHD, bezogen auf mg / m²) Iloperidon. Die höchste Dosis verursachte erhöhte frühe intrauterine Todesfälle und verringerte die Lebensfähigkeit des Fötus zum Zeitpunkt der Entbindung; Diese Dosis verursachte auch maternale Toxizität.
In weiteren Studien, in denen Ratten Iloperidon in ähnlichen Dosen wie oben verabreicht wurden, wurde entweder von der Empfängnisvorbeugung an oder von der Schwangerschaft an begonnen Tag 17 der Schwangerschaft und Fortsetzung durch Entwöhnung, negative Auswirkungen auf die Fortpflanzung, einschließlich längerer Schwangerschaft und Geburt, nahmen zu Totgeburtenraten, erhöhte Inzidenz von fetalen viszeralen Variationen, verringerte das Gewicht von Fötus und Welpe und verringerte die postpartalen Welpen Überleben. Es gab keine Arzneimittelwirkungen auf das neurologische Verhalten oder die Fortpflanzungsfähigkeit der überlebenden Welpen. Die wirkungslosen Dosen lagen im Bereich von 4 bis 12 mg / kg, mit Ausnahme der Zunahme der Totgeburtenraten, die bei der niedrigsten getesteten Dosis von 4 mg / kg auftraten, was das 1,6-fache der MRHD auf mg / m2-Basis ist. In diesen Studien wurde bei den höheren Dosen maternale Toxizität beobachtet.
Der Iloperidon - Metabolit P95, der beim Menschen ein Hauptmetabolit von Iloperidon ist, aber in P95 nicht vorhanden ist Schwangeren Ratten wurden während der Organogenese signifikante Mengen in oralen Dosen von 20, 80 oder 200 mg verabreicht kg / Tag. Es wurden keine teratogenen Wirkungen beobachtet. Bei allen Dosen trat eine verzögerte Skelettverknöcherung auf. Es wurde keine signifikante maternale Toxizität erzeugt. Die Plasmaspiegel von P95 (AUC) bei der höchsten getesteten Dosis waren doppelt so hoch wie bei Menschen, die die MRHD von Iloperidon erhielten.
Stillzeit
Risikoübersicht
Es liegen keine Informationen über das Vorhandensein von Iloperidon oder seinen Metaboliten in der Muttermilch vor Auswirkungen von Iloperidon auf ein gestilltes Kind, noch die Auswirkungen von Iloperidon auf die Muttermilch Produktion. Iloperidon ist in Rattenmilch enthalten. Raten Sie einer Frau, während der Behandlung mit FANAPT nicht zu stillen, da dies zu schwerwiegenden Nebenwirkungen bei gestillten Säuglingen führen kann.
Daten Die Übertragung von Radioaktivität in die Milch laktierender Ratten wurde nach einer Einzeldosis von [14C] Iloperidon in einer Menge von 5 mg / kg untersucht. Die Radioaktivitätskonzentration in der Milch war 4 Stunden nach der Dosis fast 10-mal höher als die im Plasma zur gleichen Zeit. Bis 24 Stunden nach der Dosierung waren die Radioaktivitätskonzentrationen in der Milch jedoch auf Werte gesunken, die geringfügig unter denen des Plasmas lagen. Das Stoffwechselprofil in der Milch war qualitativ dem im Plasma ähnlich.
Pädiatrische Anwendung Sicherheit und Wirksamkeit bei pädiatrischen und jugendlichen Patienten wurden nicht untersucht.
Geriatrische Verwendung
Klinische Studien von FANAPT zur Behandlung von Schizophrenie umfassten nicht genügend Patienten ab 65 Jahren, um festzustellen, ob sie anders ansprechen als jüngere Erwachsene Patienten. Von den 3210 Patienten, die mit FANAPT in Premarketing-Studien behandelt wurden, waren 25 (0,5%) ≥ 65 Jahre alt und es gab keine Patienten ≥ 75 Jahre alt.
Ältere Patienten mit demenzbedingter Psychose, die mit FANAPT behandelt wurden, haben im Vergleich zu Placebo ein erhöhtes Sterberisiko. FANAPT ist nicht zur Behandlung von Patienten mit demenzbedingter Psychose zugelassen.
Nierenfunktionsstörung
Da FANAPT in hohem Maße metabolisiert wird und weniger als 1% des Arzneimittels unverändert ausgeschieden werden, ist es unwahrscheinlich, dass eine Nierenfunktionsstörung allein einen signifikanten Einfluss auf die Pharmakokinetik von FANAPT hat. Eine Nierenfunktionsstörung (Kreatinin-Clearance <30 ml / min) hatte einen minimalen Einfluss auf die Cmax von Iloperidon (verabreicht in einer Einzeldosis von 3 mg) und seiner Metaboliten P88 und P95 in einem der gemessenen 3 Analyten. Die AUC0– ∞ war bei Patienten mit Nierenfunktionsstörung um 24% erhöht, um 6% verringert und um 52% für Iloperidon, P88 und P95 erhöht.
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung an FANAPT erforderlich. Bei Patienten mit mittelschwerer Leberfunktionsstörung kann eine Dosisreduktion erforderlich sein. Bei Patienten mit schwerer Leberfunktionsstörung wird FANAPT nicht empfohlen.
Bei erwachsenen Probanden mit leichter Leberfunktionsstörung wurde im Vergleich zu gesunden erwachsenen Kontrollen kein relevanter Unterschied in der Pharmakokinetik von Iloperidon, P88 oder P95 (insgesamt oder ungebunden) beobachtet. Bei Patienten mit mäßiger Leberfunktionsstörung war eine höhere (zweifache) und variablere freie Exposition gegenüber den aktiven Metaboliten P88 zu verzeichnen beobachtet im Vergleich zu gesunden Kontrollen, während die Exposition gegenüber Iloperidon und P95 im Allgemeinen ähnlich war (weniger als 50% Veränderung im Vergleich zu Steuerung). Da keine Studie an Patienten mit schwerer Leberfunktionsstörung durchgeführt wurde, wird FANAPT nicht für Patienten mit schwerer Leberfunktionsstörung empfohlen.
Rauchstatus
Basierend auf In-vitro-Studien mit menschlichen Leberenzymen ist FANAPT kein Substrat für CYP1A2. Rauchen sollte daher keinen Einfluss auf die Pharmakokinetik von FANAPT haben.
Schwangerschaft
oben
Drogenmissbrauch und Abhängigkeit
Kontrollierte Substanz
FANAPT ist keine kontrollierte Substanz.
Missbrauch
FANAPT wurde weder bei Tieren noch bei Menschen systematisch auf sein Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Während die klinischen Studien keine Tendenz zum Drogensuchverhalten zeigten, waren diese Beobachtungen nicht systematisch und es ist nicht möglich auf der Grundlage dieser Erfahrung vorherzusagen, inwieweit ein ZNS-Wirkstoff, FANAPT, einmal missbraucht, umgeleitet und / oder missbraucht wird vermarktet. Infolgedessen sollten Patienten sorgfältig auf eine Vorgeschichte von Drogenmissbrauch untersucht werden, und solche Patienten sollten dies auch tun engmaschig auf Anzeichen von FANAPT-Missbrauch (z. B. Toleranzentwicklung, Dosiserhöhung, Drogensuche) hin beobachtet Verhalten).
oben
Überdosierung
Menschliche Erfahrung
In vor der Markteinführung durchgeführten Studien mit mehr als 3210 Patienten wurde FANAPT versehentlich oder absichtlich überdosiert Es wurde bei 8 Patienten dokumentiert, die 48 mg bis 576 mg auf einmal und 292 mg über einen Zeitraum von 3 Tagen eingenommen hatten Zeitraum. In diesen Fällen wurden keine Todesfälle gemeldet. Die größte bestätigte einmalige Einnahme von FANAPT betrug 576 mg; Bei diesem Patienten wurden keine nachteiligen körperlichen Wirkungen festgestellt. Die zweitgrößte bestätigte Einnahme von FANAPT betrug 438 mg über einen Zeitraum von 4 Tagen; Für diesen Patienten wurden extrapyramidale Symptome und ein QTc-Intervall von 507 ms ohne Herzfolgen berichtet. Dieser Patient setzte die Behandlung mit FANAPT für weitere 11 Monate fort.
Im Allgemeinen waren die berichteten Anzeichen und Symptome solche, die aus einer Übertreibung der bekannten pharmakologischen Wirkungen (z. B. Schläfrigkeit und Sedierung, Tachykardie und Hypotonie) von FANAPT resultierten.
Management von Überdosierungen
Es gibt kein spezifisches Gegenmittel für FANAPT. Daher sollten geeignete unterstützende Maßnahmen eingeleitet werden. Im Falle einer akuten Überdosierung sollte der Arzt einen Atemweg einrichten und aufrechterhalten und für eine ausreichende Sauerstoffversorgung und Belüftung sorgen. Eine Magenspülung (nach Intubation, wenn der Patient bewusstlos ist) und die Verabreichung von Aktivkohle zusammen mit einem Abführmittel sollten in Betracht gezogen werden. Die Möglichkeit von Obtundation, Krampfanfällen oder dystonischen Reaktionen von Kopf und Hals nach Überdosierung kann zu einem Aspirationsrisiko mit induziertem Erbrechen führen. Die kardiovaskuläre Überwachung sollte sofort beginnen und eine kontinuierliche EKG-Überwachung umfassen, um mögliche Arrhythmien zu erkennen. Wenn eine antiarrhythmische Therapie angewendet wird, sollten Disopyramid, Procainamid und Chinidin nicht angewendet werden, da sie möglicherweise eine QT-verlängernde Wirkung haben, die zu denen von FANAPT additiv sein kann. Ebenso ist zu erwarten, dass die alpha-blockierenden Eigenschaften von Bretylium zu denen von FANAPT additiv sein können, was zu einer problematischen Hypotonie führt. Hypotonie und Kreislaufkollaps sollten mit geeigneten Maßnahmen wie intravenösen Flüssigkeiten oder Sympathomimetika behandelt werden (Adrenalin und Dopamin sollten nicht angewendet werden, da die Beta-Stimulation die Hypotonie bei der Einstellung von FANAPT-induziertem Alpha verschlimmern kann Blockade). Bei schweren extrapyramidalen Symptomen sollten Anticholinergika verabreicht werden. Die ärztliche Überwachung sollte so lange fortgesetzt werden, bis sich der Patient erholt hat.
oben
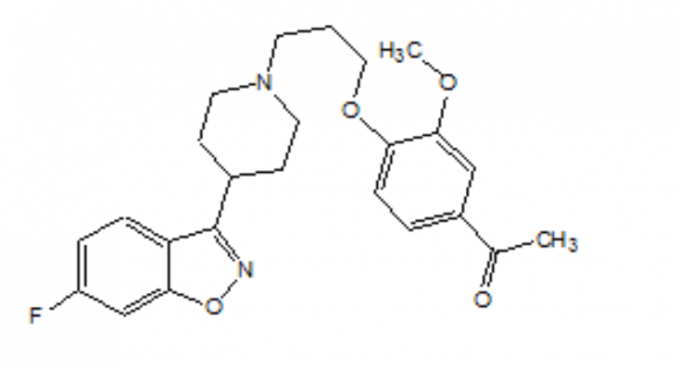
Beschreibung
FANAPT ist ein atypisches Antipsychotikum der chemischen Klasse der Piperidinylbenzisoxazolderivate. Sein chemischer Name ist 4'- [3- [4- (6-Fluor-1,2-benzisoxazol-3-yl) piperidino] propoxy] -3'-methoxyacetophenon. Seine Molekülformel lautet C24H27FN2O4 und sein Molekulargewicht beträgt 426,48. Die Strukturformel lautet:
Iloperidon ist ein weißes bis cremefarbenes, feinkristallines Pulver. Es ist in Wasser praktisch unlöslich, in 0,1 N HCl sehr schwer löslich und in Chloroform, Ethanol, Methanol und Acetonitril frei löslich.
FANAPT-Tabletten sind nur zur oralen Anwendung bestimmt. Jede Runde unbeschichtet
Tablette enthält 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg oder 12 mg Iloperidon. Inaktive Bestandteile sind: Lactosemonohydrat, mikrokristalline Cellulose, Hydroxypropylmethylcellulose, Crospovidon, Magnesiumstearat, kolloidales Silicium
Dioxid und gereinigtes Wasser (bei der Verarbeitung entfernt). Die Tabletten sind weiß, rund, flach, mit abgeschrägten Kanten versehen und mit einem einseitig geprägten Logo und der Tablettenstärke „1“, „2“, „4“, „6“, „8“, „10“ gekennzeichnet. oder "12" auf der anderen Seite geprägt.
oben
Klinische Pharmakologie
Wirkmechanismus
Der Wirkungsmechanismus von Iloperidon bei Schizophrenie ist unbekannt. Die Wirksamkeit von Iloperidon könnte jedoch durch eine Kombination von Dopamin Typ 2 (D2) - und Serotonin Typ 2 (5-HT2) -Antagonismus vermittelt werden.
Iloperidon bildet einen aktiven Metaboliten, P88, der ein dem Ausgangsarzneimittel ähnliches in vitro-Rezeptorbindungsprofil aufweist.
Pharmakodynamik
Iloperidon wirkt als Antagonist mit hoher (nM) Affinität an Serotonin-5-HT2A-Dopamin D2 und D3-Rezeptoren und Noradrenalin-NEα1-Rezeptoren (Ki-Werte von 5,6, 6,3, 7,1 und 0,36 nM) beziehungsweise). Iloperidon hat eine mäßige Affinität zu Dopamin D4 und Serotonin-5-HT6- und 5-HT7-Rezeptoren (Ki-Werte von 25, 43 und 22 nM) und niedrige Affinität für die Serotonin-5-HT1A-, Dopamin-D1- und Histamin-H1-Rezeptoren (Ki-Werte von 168, 216 und 437 nM), beziehungsweise). Iloperidon hat keine nennenswerte Affinität (Ki> 1000 nM) zu cholinergen Muskarinrezeptoren. Die Affinität des Iloperidon-Metaboliten P88 ist im Allgemeinen gleich oder geringer als die der Ausgangsverbindung, während der Metabolit P95 allein ist zeigt die Affinität für 5-HT2A (Ki-Wert von 3,91) und die NEα1A-, NEα1B-, NEα1D- und NEα2C-Rezeptoren (Ki-Werte von 4,7, 2,7, 8,8 und 4,7 nM) beziehungsweise).
Pharmakokinetik
Die beobachteten mittleren Eliminationshalbwertszeiten für Iloperidon, P88 und P95 in CYP2D6-Extensivmetabolisierern (EM) sind 18, 26 bzw. 23 Stunden und bei schlechten Metabolisierern (PM) sind es 33, 37 bzw. 31 Stunden. Steady-State-Konzentrationen werden innerhalb von 3-4 Tagen nach der Dosierung erreicht. Die Akkumulation von Iloperidon ist aus der Pharmakokinetik einer Einzeldosis vorhersehbar. Die Pharmakokinetik von Iloperidon ist mehr als dosisproportional. Die Elimination von Iloperidon erfolgt hauptsächlich über den Leberstoffwechsel unter Beteiligung von 2 P450-Isozymen, CYP2D6 und CYP3A4.
Resorption: Iloperidon wird nach Verabreichung der Tablette gut resorbiert, wobei maximale Plasmakonzentrationen innerhalb von 2 bis 4 Stunden auftreten. Die relative Bioverfügbarkeit der Tablettenformulierung im Vergleich zur Lösung zum Einnehmen beträgt 96%. Die Verabreichung von Iloperidon mit einer fettreichen Standardmahlzeit hatte keinen signifikanten Einfluss auf Cmax oder AUC von Iloperidon, P88 oder P95, aber verzögerte Tmax um 1 Stunde für Iloperidon, 2 Stunden für P88 und 6 Stunden für P95. FANAPT kann unabhängig von den Mahlzeiten angewendet werden.
Verteilung: Iloperidon weist eine scheinbare Clearance (Clearance / Bioverfügbarkeit) von 47 bis 102 l / h mit einem scheinbaren Verteilungsvolumen von 1340 bis 2800 l auf. In therapeutischen Konzentrationen beträgt der ungebundene Anteil von Iloperidon im Plasma ~ 3% und von jedem Metaboliten (P88 und P95) ~ 8%.
Metabolismus und Elimination: Iloperidon wird hauptsächlich über 3 Biotransformationswege metabolisiert: Carbonylreduktion, Hydroxylierung (vermittelt durch CYP2D6) und O-Demethylierung (vermittelt durch CYP3A4). Es gibt 2 vorherrschende Iloperidon-Metaboliten, P95 und P88. Der Iloperidon-Metabolit P95 repräsentiert 47,9% der AUC von Iloperidon und seinen Metaboliten im Plasma im Steady-State für extensive Metabolisierer (EM) und 25% für arme Metabolisierer (PM). Der aktive Metabolit P88 macht 19,5% bzw. 34,0% der gesamten Plasmaexposition in EM und PM aus.
Ungefähr 7-10% der Kaukasier und 3-8% der Schwarz- / Afroamerikaner sind nicht in der Lage, CYP2D6 zu metabolisieren Substrate und werden als schlechte Metabolisierer (PM) eingestuft, während der Rest mittelschwer, extensiv oder ultraschnell ist Metabolisierer. Die gleichzeitige Anwendung von FANAPT mit bekannten starken CYP2D6-Inhibitoren wie Fluoxetin führt zu einem 2,3-fachen Erhöhung der Iloperidon-Plasmaexposition, daher sollte die Hälfte der FANAPT-Dosis betragen verabreicht.
In ähnlicher Weise weisen PMs mit CYP2D6 im Vergleich zu EMs eine höhere Iloperidon-Exposition auf, und bei PMs sollte die Dosis um die Hälfte reduziert werden. Labortests stehen zur Verfügung, um CYP2D6-PMs zu identifizieren.
Der Großteil des radioaktiven Materials wurde im Urin zurückgewonnen (Mittelwert 58,2% und 45,1% in EM bzw. PM), wobei Kot 19,9% (EM) bis 22,1% (PM) der dosierten Radioaktivität ausmachte.
Transporter-Wechselwirkung: Iloperidon und P88 sind keine Substrate von P-gp und Iloperidon ist ein schwacher P-gp-Inhibitor.
oben
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Fruchtbarkeitsstörung
Karzinogenese: Studien zur lebenslangen Karzinogenität wurden an CD-1-Mäusen und Sprague Dawley-Ratten durchgeführt. Iloperidon wurde CD-1-Mäusen in Dosen von 2,5, 5,0 und 10 mg / kg / Tag und 4, 8 und 16 mg / kg / Tag bis oral verabreicht Sprague Dawley-Ratten (0,5-, 1,0- und 2,0-fache bzw. 1,6-, 3,2- und 6,5-fache MRHD von 24 mg / Tag auf mg / m²) Basis). Bei weiblichen Mäusen, die nur mit der niedrigsten Dosis (2,5 mg / kg / Tag) behandelt wurden, traten vermehrt bösartige Brustdrüsentumoren auf. Es gab keine behandlungsbedingten Anstiege der Neoplasie bei Ratten.
Das karzinogene Potenzial des Iloperidon-Metaboliten P95, der beim Menschen ein wichtiger zirkulierender Metabolit von Iloperidon ist, bei Mäusen oder Tieren jedoch nicht in signifikanten Mengen vorhanden ist Ratten wurde in einer lebenslangen Kanzerogenitätsstudie an Wistar - Ratten in oralen Dosen von 25, 75 und 200 mg / kg / Tag bei Männern und von 50, 150 und 250 (reduziert von 400) mg / kg / Tag bei Ratten untersucht Frauen. Arzneimittelbedingte neoplastische Veränderungen traten bei Männern, in der Hypophyse (Pars distalis Adenom) bei allen Dosen und in der Bauchspeicheldrüse (Inselzelladenom) bei der hohen Dosis auf. Die Plasmakonzentrationen von P95 (AUC) bei Männern in den getesteten Dosen (25, 75 und 200 mg / kg / Tag) betrugen ungefähr das 0,4-, 3- bzw. 23-fache der Exposition des Menschen gegenüber P95 bei der MRHD von Iloperidon.
Mutagenese: Iloperidon war im Ames-Test und im In-vivo-Mikrokerntest für Knochenmark und Rattenleber bei Mäusen negativ. Iloperidon induzierte in vitro Chromosomenaberrationen in Ovarialzellen des Chinesischen Hamsters (CHO) in Konzentrationen, die ebenfalls eine gewisse Zytotoxizität hervorriefen.
Der Iloperidon-Metabolit P95 war im Ames-Test, im V79-Chromosomenaberrationstest und im In-vivo-Knochenmark-Mikronukleus-Test der Maus negativ.
Beeinträchtigung der Fertilität: Iloperidon verringerte die Fertilität bei 12 und 36 mg / kg in einer Studie, in der sowohl männliche als auch weibliche Ratten behandelt wurden. Die wirkungslose Dosis betrug 4 mg / kg, das 1,6-fache der MRHD von 24 mg / Tag, bezogen auf mg / m².
oben
Klinische Studien
Die Wirksamkeit von FANAPT bei der Behandlung von Schizophrenie wurde durch 2 Placebo- und aktiv kontrollierte Kurzzeitstudien (4- und 6-wöchig) und eine placebokontrollierte Langzeitstudie randomisiert Entzugsversuch. In allen Studien wurden Patienten eingeschlossen, die die DSM-III / IV-Kriterien für Schizophrenie erfüllten.
In diesen Studien wurden drei Instrumente zur Bewertung psychiatrischer Anzeichen und Symptome verwendet. Die Positiv- und Negativ-Syndrom-Skala (PANSS) und die kurze psychiatrische Bewertungsskala (BPRS) sind beides Inventare mit mehreren Elementen.
der allgemeinen Psychopathologie in der Regel verwendet, um die Auswirkungen der medikamentösen Behandlung bei Schizophrenie zu bewerten. Die Beurteilung des klinischen Gesamteindrucks (CGI) spiegelt den Eindruck eines erfahrenen Beobachters wider, der mit den Manifestationen der Schizophrenie vertraut ist, und zwar über den gesamten klinischen Zustand des Patienten.
Eine 6-wöchige, placebokontrollierte Studie (n = 706) umfasste 2 flexible Dosisbereiche von FANAPT (12-16 mg / Tag oder 20-24 mg / Tag) im Vergleich zu Placebo und einer aktiven Kontrolle (Risperidon). Für die Gruppe mit 12-16 mg / Tag betrug das Titrationsschema von FANAPT zweimal täglich 1 mg an den Tagen 1 und 2, zweimal täglich 2 mg an den Tagen 3 und 4, zweimal täglich 4 mg an den Tagen 5 und 6 und zweimal 6 mg täglich am Tag 7. Für die Gruppe mit 20 bis 24 mg / Tag betrug der Titrationsplan von FANAPT am Tag 1 zweimal täglich 1 mg, am Tag 2 zweimal täglich 2 mg. 4 mg zweimal täglich am 3. Tag, 6 mg zweimal täglich am 4. und 5. Tag, 8 mg zweimal täglich am 6. Tag und 10 mg zweimal täglich am 7. Tag. Der primäre Endpunkt war die Veränderung des BPRS-Gesamtscore am Ende der Behandlung gegenüber dem Ausgangswert (Tag 42). Sowohl der Dosisbereich von 12-16 mg / Tag als auch der von 20-24 mg / Tag von FANAPT waren im BPRS-Gesamtscore dem Placebo überlegen. Das aktive Kontroll-Antipsychotikum schien FANAPT in dieser Studie innerhalb der ersten 2 überlegen zu sein Wochen, ein Befund, der zum Teil durch die dafür mögliche schnellere Titration erklärt werden kann Droge. Bei Patienten in dieser Studie, die mindestens 2 Wochen lang behandelt wurden, schien Iloperidon eine vergleichbare Wirksamkeit wie die aktive Kontrolle zu haben.
Eine 4-wöchige, placebokontrollierte Studie (n = 604) umfasste eine feste Dosis FANAPT (24 mg / Tag) im Vergleich zu Placebo und einer aktiven Kontrolle (Ziprasidon). Der Titrationsplan für diese Studie war dem für die 6-wöchige Studie ähnlich. Diese Studie umfasste die Titration von FANAPT, beginnend mit 1 mg zweimal täglich am Tag 1 und steigend auf 2, 4, 6, 8, 10 und 12 mg zweimal täglich am Tag 2, 3, 4, 5, 6 und 7. Der primäre Endpunkt war die Veränderung des PANSS-Gesamtscore am Ende der Behandlung gegenüber dem Ausgangswert (Tag 28). Die FANAPT-Dosis von 24 mg / Tag war im PANSS-Gesamtscore dem Placebo überlegen. FANAPT schien eine ähnliche Wirksamkeit zu haben wie das aktive Kontrollarzneimittel, für das auch eine langsame Titration der Zieldosis erforderlich war.
In einer Langzeitstudie erfüllten klinisch stabile erwachsene ambulante Patienten (n = 303) die DSM-IV-Kriterien für Schizophrenie, die nach 12 Wochen stabil blieben Open-Label-Behandlung mit flexiblen Dosen von FANAPT (8 mg / Tag - 24 mg / Tag, verabreicht als zweimal tägliche Dosen) wurden randomisiert auf Placebo umgestellt oder fortgesetzt ihre derzeitige FANAPT-Dosis (8 mg / Tag - 24 mg / Tag, zweimal täglich verabreicht) zur Beobachtung eines möglichen Rückfalls während des doppelblinden Rückfalls Präventionsphase. Die Stabilisierung während der Open-Label-Phase wurde als auf einer festgelegten Dosis von FANAPT beruhend definiert, die aufgrund der Wirksamkeit in den 4 Wochen vor der Randomisierung unverändert war. mit einem CGI-Schweregrad von ≤4 und einem PANSS-Gesamtwert von ≤70, einem Wert von ≤4 für jeden der folgenden einzelnen PANSS-Punkte (P1-Wahnvorstellungen, P2-konzeptionelle Desorganisation, P3-halluzinatorisches Verhalten, P6-Misstrauen / Verfolgung, P7-Feindseligkeit oder G8-Unkooperativität) und keine Krankenhauseinweisung oder Erhöhung der zu behandelnden Pflegestufe Exazerbationen. Ein Rückfall oder ein bevorstehender Rückfall während der doppelblinden Rückfallverhütungsphase wurde als eine der folgenden definiert Folgende: Krankenhausaufenthalt aufgrund einer Verschlechterung der Schizophrenie, Erhöhung (Verschlechterung) des PANSS-Gesamtscore ≥ 30%, CGI-
Verbesserungs-Score ≥6, Patient hatte Selbstmord-, Mord- oder aggressives Verhalten oder benötigte ein anderes Antipsychotikum.

Basierend auf der Zwischenanalyse entschied ein unabhängiger Datenüberwachungsausschuss, dass die Studie aufgrund von Wirksamkeitsnachweisen vorzeitig abgebrochen werden sollte. Basierend auf den Ergebnissen der Zwischenanalyse, die durch den endgültigen Analysedatensatz bestätigt wurden, behandelten Patienten mit FANAPT erlebte eine statistisch signifikant längere Zeit bis zum Rückfall oder bevorstehenden Rückfall als Patienten, die erhielten Placebo. Abbildung 1 zeigt den geschätzten kumulativen Anteil von Patienten mit Rückfall oder bevorstehendem Rückfall basierend auf dem endgültigen Datensatz.
oben
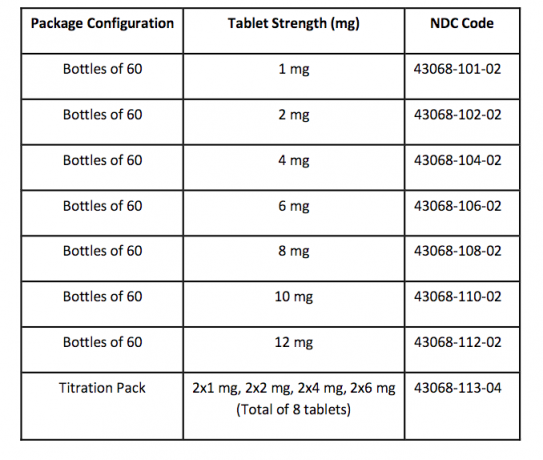
Lieferform / Lagerung und Handhabung
FANAPT-Tabletten sind weiß, rund und mit einem Logo auf der einen Seite und der Tablettstärke „1“, „2“, „4“, „6“, „8“, „10“ oder „12“ auf der anderen Seite gekennzeichnet Seite. Tablets werden in den folgenden Stärken und Packungskonfigurationen geliefert:
Lager
Lagern Sie FANAPT-Tabletten bei kontrollierter Raumtemperatur, 25 ° C (77 ° F); zulässige Abweichungen von 15 ° bis 30 ° C (59 ° bis 86 ° F) [Siehe USP Controlled Room Temperature]. Schützen Sie die FANAPT-Tabletten vor Licht und Feuchtigkeit.
PATIENTENBERATUNGSINFORMATIONEN
Ärzten wird empfohlen, die folgenden Fragen mit Patienten zu besprechen, für die sie FANAPT verschreiben:
QT-Intervallverlängerung
Patienten sollten angewiesen werden, sofort einen Arzt aufzusuchen, wenn sie sich ohnmächtig fühlen, das Bewusstsein verlieren oder Herzklopfen haben. Patienten sollten angewiesen werden, FANAPT nicht zusammen mit anderen Arzneimitteln einzunehmen, die eine Verlängerung des QT-Intervalls verursachen. Die Patienten sollten angewiesen werden, die Ärzte darüber zu informieren, dass sie FANAPT einnehmen, bevor ein neues Medikament eingenommen wird.
Malignes neuroleptisches Syndrom
Patienten und Pflegepersonen sollten darauf hingewiesen werden, dass ein möglicherweise tödlicher Symptomkomplex manchmal genannt wird to as NMS wurde in Verbindung mit der Verabreichung von Antipsychotika, einschließlich FANAPT, berichtet. Anzeichen und Symptome von NMS sind Hyperpyrexie, Muskelsteifheit, veränderter Geisteszustand und der Nachweis einer Autonomie
Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzrhythmusstörungen).
Stoffwechselveränderungen
Die Patienten sollten die Symptome von Hyperglykämie (hoher Blutzucker) und Diabetes mellitus kennen. Patienten, bei denen Diabetes diagnostiziert wird, die Risikofaktoren für Diabetes haben oder die diese entwickeln Bei Symptomen während der Behandlung sollte der Blutzucker zu Beginn und in regelmäßigen Abständen während der Behandlung überwacht werden Behandlung. Den Patienten sollte mitgeteilt werden, dass während der Behandlung mit FANAPT eine Gewichtszunahme aufgetreten ist. Die klinische Überwachung des Gewichts wird empfohlen.
Orthostatische Hypotonie
Die Patienten sollten über das Risiko einer orthostatischen Hypotonie aufgeklärt werden, insbesondere zu Beginn der Behandlung, zu Wiederaufnahme der Behandlung oder zur Erhöhung der Dosis.
Beeinträchtigung der kognitiven und motorischen Leistung
Da FANAPT möglicherweise das Urteilsvermögen, das Denken oder die motorischen Fähigkeiten beeinträchtigt, sollten Patienten gewarnt werden Bedienen gefährlicher Maschinen, einschließlich Autos, bis hinreichend sicher ist, dass sie durch die FANAPT-Therapie nicht beeinträchtigt werden nachteilig.
Schwangerschaft
Patienten darauf hinweisen, dass die Anwendung von Fanapt im dritten Trimester bei Neugeborenen extrapyramidale und / oder Entzugssymptome verursachen kann. Weisen Sie die Patientinnen an, ihren Arzt über bekannte oder vermutete Schwangerschaften zu informieren.
Schwangerschaftsregister
Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschaftsregister gibt, das die Schwangerschaftsergebnisse bei Frauen überwacht, die während der Schwangerschaft FANAPT ausgesetzt waren
Stillzeit
Empfehlen Sie Frauen, während der Behandlung mit FANAPT nicht zu stillen.
Begleitmedikation
Patienten sollten angewiesen werden, ihre Ärzte zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Medikamente einnehmen oder planen, diese einzunehmen, da die Möglichkeit von Wechselwirkungen besteht.
Alkohol
Patienten sollten angewiesen werden, Alkohol während der Einnahme von FANAPT zu vermeiden.
Hitzeeinwirkung und Dehydration
Die Patienten sollten hinsichtlich der angemessenen Pflege zur Vermeidung von Überhitzung und Austrocknung beraten werden.
Vertrieben von:
Vanda Pharmaceuticals Inc.
Washington, D. C. 20037 USA
Vanda und Fanapt® sind eingetragene Marken von Vanda Pharmaceuticals Inc. in den Vereinigten Staaten und anderen Ländern.
Zurück nach oben
Verschreibungshandbuch für Fanapt (Iloperidone) (PDF)
Die Informationen in dieser Monographie sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Arzneimittelwechselwirkungen oder Nebenwirkungen abdecken. Diese Informationen sind verallgemeinert und nicht als spezifischer medizinischer Rat gedacht. Wenn Sie Fragen zu den Arzneimitteln haben, die Sie einnehmen, oder weitere Informationen wünschen, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
Zuletzt aktualisiert am 13.07
zurück zu: Psychiatrische Medikamente Pharmakologie Homepage


